Presentación de caso
Síndrome de DRESS asociado al uso de anticonvulsivantes
DRESS syndrome associated to the use of anticonvulsant medications
Antonio
Belaunde Clausell1*
https://orcid.org/0000-0002-5602-0188
Yonaiky Pacheco
Otero2 https://orcid.org/0000-0001-8328-742X
Rubén Manuel
Peña Ruiz2
https://orcid.org/0000-0002-4204-1084
1Hospital
Militar Central "Dr. Carlos J. Finlay". La Habana, Cuba.
2Hospital
Militar Central "Dr. Luis Días Soto". La Habana. Cuba.
*Autor para la correspondencia. Correo electrónico: hfinlay32@infomed.sld.cu
RESUMEN
Introducción: El síndrome Drug Reaction with Eosinophilia and Systemic Symptoms
- DRESS, constituye una grave reacción adversa a medicamentos, principalmente
a fármacos anticonvulsivantes.
Objetivo: Describir la evolución clínica de un síndrome de DRESS en una
paciente atendida en el Hospital Militar Central "Dr. Luis Díaz Soto".
Caso Clínico: Paciente femenina de 27 años de edad con antecedentes patológicos
personales de epilepsia. Tres meses luego de iniciada terapia con difenilhidantoína
aparece fiebre, exantema maculopapular que progresa a eritrodermia exfoliativa,
signos de daño hepático, adenopatías cervicales y eosinofilia.
Se diagnosticó síndrome de DRESS secundaria al uso de anticonvulsivantes.
Conclusiones:
La evolución clínica resultó favorable, luego de la retirada
del fármaco y la aplicación de esteroides por vía oral.
Palabras claves: fiebre; eosinofilia; exantema; anticonvulsivante.
ABSTRACT
Introduction:
Drug Reaction with Eosinophilia and Systemic Symptoms - DRESS, syndrome constitutes
a serious adverse reaction to medications, mainly anticonvulsant drugs.
Objective: To describe the clinical evolution of DRESS syndrome in a patient treated at
the Hospital Militar Central "Dr. Luis Díaz Soto".
Case Report:
27-year-old female patient with a personal pathological history of epilepsy.
Three months after initiation of diphenylhydantoin therapy, fever appeared maculopapular
rash that progressed to exfoliative erythroderma, signs of liver damage, cervical
adenopathies and eosinophilia. DRESS syndrome was diagnosed secondary to the
use of anticonvulsants.
Conclusions:
The clinical evolution was favorable, after the withdrawal of the drug and the
application of steroids orally.
Keywords: fever; eosinophilia; exanthema; anticonvulsant.
Recibido:
09/06/2019
Aprobado: 03/02/2020
INTRODUCCIÓN
El síndrome de DRESS (Drug Reaction with Eosinophilia and Systemic Symptoms por sus siglas en inglés) constituye una grave reacción adversa a medicamentos, principalmente a fármacos anticonvulsivantes.(1) Aunque ya desde 1940 existen reportes en la literatura de síndromes de hipersensibilidad cutánea asociados a antiepilépticos, la primera descripción de la entidad, ahora conocida como DRESS, fue hecha en 1959 por Sidney Saltzstein, el cual utilizó el término "linfoma inducido por medicamentos" para describir las reacciones adversas cutáneas y hallazgos histológicos compatibles con linfoma.(2,3) Bocquet y otros definieron y caracterizaron a esta enfermedad y la nombraron síndrome DRESS.(4)
Aunque se han utilizado numerosos sinónimos, la mayoría hace referencia al fármaco implicado en la reacción (por ejemplo, síndrome por dapsona, síndrome de hipersensibilidad al alopurinol o síndrome de hipersensibilidad por anticomiciales). Por último, si bien el trastorno incluye una dermatosis característica, la extensión del compromiso cutáneo suele ser variable, de allí que la "R" del acrónimo fuera cambiada de "rash" (erupción) a "reacción".(5)
Este síndrome tiene una incidencia estimada de aparición entre 1:1 000 a 1:10 000 pacientes expuestos a drogas. Aparece generalmente después de 2 a 6 semanas de haber iniciado la terapia farmacológica y los síntomas pueden agravarse si no se suspende el fármaco implicado.(1)
El síndrome de DRESS tiene una mortalidad estimada del 10 %, mayor a procesos graves como el síndrome Stevens-Johnson (1- 5 %) y pustulosis exantémica generalizada (5 %) pero menor a la causada por necrólisis epidérmica tóxica; todas estas con una alta tasa de complicaciones y/o secuelas. El manejo principal consiste en suspender el fármaco causante, iniciar manejo hemodinámico inmediato y administrar corticoesteroides sistémicos.(1) Se realiza el presente reporte de caso con el objetivo de describir la evolución de un caso con síndrome DRESS por anticonvulsivantes.
CASO
CLÍNICO
Paciente femenina, de 27 años, mestiza, con antecedentes personales de salud aparente, hasta 3 meses antes del ingreso, cuando presenta dos episodios convulsivos y se diagnostica epilepsia. Comenzó tratamiento con difenilhidantoína (tableta de 50 mg) 5 tabletas diarias. Una semana antes del ingreso comenzó con fiebre de 38 ˚C, dos picos al día durante dos días, asociada a artralgias de grandes articulaciones y toma marcada del estado general. Siete días después reapareció la fiebre de 38- 38,5 ˚C, dos picos al día, sin escalofríos, con un patrón remitente, por tal motivo se decidió su ingreso.
Examen físico: mucosas húmedas, con ictericia de tonalidad rubínica; se constata en la piel exantema maculopapular generalizado, pruriginoso; hepatomegalia que rebasa el reborde costal en cinco traveses de dedo, no dolorosa, de bordes romos y superficie lisa; adenopatías cervicales posteriores y axilares de aproximadamente 2 cm de diámetro, no dolorosas, fibroelásticas y no adheridas a planos profundos.
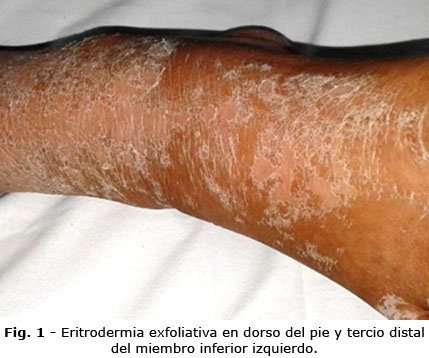
Evolución: fue ingresada con diagnóstico de zika. Tuvo evolución tórpida con empeoramiento del estado general; persistía la hipertermia; el exantema maculopapular progresó a eritrodermia exfoliativa (Fig. 1 y Fig. 2). Se decidió suspender el tratamiento con difenilhidantoína y comenzar tratamiento profuso con soluciones hidroelectrolíticas y prednisona, 50 mg.
A los 30 días de hospitalización, la bilirrubina, la alanina aminotransferasa y la aspartato aminotransferasa habían descendido a valores normales. Se dio alta a la paciente con tratamiento a base de 30 mg de prednisona, con esquema de reducción. El tratamiento anticonvulsivo se instaló a base de ácido valproico.
Complementarios: hemoglobina 12,2 g/L; leucocitosis 13,5 x 109 /L; neutrófilos 25 %; linfocitos 0,1 %; eosinófilos 1,6 %; plaquetas 193 x 109/L; VSG 80 mm/h; TGO 378 U/L; TGP 673 U/L; GGT 340 U/L; FAL 263 U/L; creatinina 183 µmol/L; glucosa 8,3 mmol/L; bilirrubina total 64,6 mmol/L; bilirrubina directa 58,6 mmol/L; proteínas totales 58,4 mmol/L, albúmina 35 mmol/L; colesterol 2,9 mmol/L, triacilglicéridos 2,31 mmol/L.
Lámina periférica: hipocromía; macrocitos X; poiquilocitosis: crenocitos, ovalocitos y estomatocitos.
Coagulograma: coágulo retráctil; tiempo de protrombina, control 14'', paciente 34''. Tiempo parcial de tromboplastina 21,2''.
Ecografía abdominal: hígado que rebasa el reborde costal en 5 cm; bordes romos, no lesiones focales; vesícula y vías biliares sin alteraciones; riñones y páncreas normales; bazo que mide 133 x 90 mm. No hay líquido libre en la cavidad abdominal.
Serología para VIH, sífilis, VHB y VHC: negativos; hemocultivos seriados: negativos.
COMENTARIOS
La patogenia del síndrome DRESS no ha sido del todo esclarecida. Se han postulado diversas causas, como defectos de desintoxicación que producen metabolitos reactivos que actúan como haptenos y desencadenan una respuesta inmune específica contra el fármaco, mediada por linfocitos T.(5)
Los medicamentos que se han asociado a DRESS incluyen, en primer lugar, carbamazepina, seguida por alopurinol, sulfasalazina, fenobarbital, lamotrigina, fenitoína, abacavir, difenilsulfona, vancomicina, beta bloqueadores, IECA, minociclina, AINEs, cefalosporinas y fármacos antituberculosos.(6,7)
El síndrome se manifiesta entre 3 semanas y 3 meses después de administrar la droga (promedio: 2 meses), pero es más acelerado en casos de reiniciar el uso de la sustancia.(8)
Los síntomas iniciales son: fiebre (90- 100 % de los casos) elevada (38- 40 ˚C) que persiste días o semanas y erupción morbiliforme (87 %).(9)
La reacción cutánea consiste en una erupción morbiliforme similar a la que puede observarse en otras reacciones medicamentosas menos graves.(10)
Las lesiones aparecen inicialmente en cara, tronco superior y extremidades superiores, pueden progresar después hacia extremidades inferiores y en etapas tardías se disemina en piernas; evoluciona a una erupción eritrodérmica cuya severidad no refleja el compromiso de los órganos internos.(10)
A diferencia de la necrólisis epidérmica tóxica, no hay necrosis de la epidermis excepto en raros casos en que estas entidades son concomitantes, se observan pústulas perifoliculares pequeñas y no foliculares, cuyo aspecto es distinto de la pustulosis exantemática generalizada y no muestra predominio en pliegues cutáneos. Con la evolución, la erupción se vuelve purpúrica y al final se observa una descamación generalizada de tipo folicular.(5)
Es común (70- 75 % de los casos) hallar linfadenopatía.(11) El compromiso multiorgánico involucra numerosos órganos y sistemas. Las complicaciones pueden incluir miocarditis/ miositis, pericarditis, nefritis intersticial, granulomatosis necrosante y vasculitis renal, encefalitis o meningitis, colitis y tiroiditis. El compromiso multiorgánico es potencialmente mortal, casi siempre inicia 1-2 semanas después de la aparición de la erupción. Se ha informado de estados de choque y síndrome de distrés respiratorio.(11)
Después de linfadenopatía, el compromiso hepático es la complicación visceral más común (50- 60 %), y a menudo es posible detectar hepatomegalia durante la exploración física. El daño abarca desde una leve elevación de enzimas hepáticas asintomática hasta una hepatitis tóxica aguda que puede evolucionar a la necrosis total y como es de suponer, el uso concomitante de fármacos hepatotóxicos puede agravar el cuadro. (5,12)
Se ha postulado que ocurre daño renal en 11 % de los pacientes, que se manifiesta con cuadros muy diversos e incluye desde hematuria leve y nefritis hasta falla renal.(5)
El grupo "Registro de reacciones adversas cutáneas graves" de México (RegiSCAR) sugirió criterios para los pacientes hospitalizados con erupción cutánea y con sospecha de síndrome DRESS:(5)
Un grupo japonés que investigó las reacciones cutáneas adversas graves a medicamentos (SCAR-J) adoptó otros criterios: (4)
Esta paciente cumplía siete de los criterios propuestos por RegisCar y cinco de los criterios propuestos por el grupo japonés.
Los diagnósticos diferenciales incluyen al síndrome de Stevens-Johnson, caracterizado por lesiones cutáneas en diana que afectan menos de 10 % de la superficie corporal y comprometen las mucosas (90 % de los casos). El cuadro sintomático de DRESS y el síndrome de Stevens-Johnson suele iniciar 2 a 6 semanas después de establecida la terapia medicamentosa, de allí la utilidad de los exámenes paraclínicos para determinar el origen de una dermatosis confusa. Otros diagnósticos diferenciales a considerar son: linfoma, infecciones agudas del virus de Epstein-Barr, virus de hepatitis A y B, estreptococo, pustulosis aguda exantemática generalizada, enfermedad de Still y enfermedad de Kawasaki.(4,5)
El síndrome de DRESS constituye una grave reacción adversa a un fármaco de tipo idiosincrática. Se debe sospechar siempre en un paciente que se encuentra bajo tratamiento reciente con alguno de los fármacos antes mencionados, en el que aparece erupción morbiliforme, signos de compromiso hepático, fiebre, hipereosinofilia y linfadenopatía. Debido a que su mortalidad es de hasta 10 %, debe tenerse un alto índice de sospecha clínica. Además de la inmediata suspensión del fármaco causante, la literatura incluye suficientes evidencias para implementar una terapia inicial con esteroides.
REFERENCIAS BIBLIOGRÁFICAS
1. Castejón Cruz OA, López Salgado DA, Sánchez Barrera RE, Oviedo Ayala EA, Ponce Gómez MK. Síndrome de DRESS desencadenado por Fenitoína: Comunicación de un caso. CIMEL 2016[acceso: 26/07/2019];21(2):65-68. Disponible en: https://www.cimel.felsocem.net/index.php/CIMEL/article/view/650/368
2. Rosenbaum J, Alex G, Roberts H. Drug rash with eosinophilia and systemic symptoms secondary to sulfasalazine. J Paediatr Child Health. 2010[acceso: 26/07/2019]; 46(4):193-6. Disponible en: https://onlinelibrary.wiley.com/doi/full/10.1111/j.1440-1754.2009.01660.x
3. Walsh S, Creamer D. Drug reaction with eosinophilia and systemic symptoms (DRESS): a clinical update review of current thinking. Clinical and Experimental Dermatology. 2011[acceso: 26/07/2019]; 36(1):6-11. Disponible en: https://onlinelibrary.wiley.com/doi/full/10.1111/j.1365-2230.2010.03967.x
4. Fernández de Córdova-Rodríguez LR, Guzmán Guillén KA, Fernández de Córdova-Aguirre JC. Síndrome DRESS o reacción a fármacos con eosinofilia y síntomas sistémicos asociada con el consumo de fármacos antituberculosos. Revista Alergia México. 2015[acceso: 24/07/2019]; 62(2):149-56. Disponible en: https://eds.a.ebscohost.com/eds/detail/detail?vid=0&sid=1647ea74-f974-4077-85f1-616e739f7a89%40sessionmgr4007&bdata=Jmxhbmc9ZXMmc2l0ZT1lZHM-tbGl2ZQ%3d%3d
5. Osuna Osuna J, Toledo Bahena ME, Valencia Herrera A, Ramírez Cortés E, Mena Cedillos C. Reacción por drogas con eosinofilia: Síndrome DRESS, un gran simulador. Dermatología CMQ. 2013[acceso: 16/06/2019]; 11(2):142-7. Disponible en: https://www.medigraphic.com/pdfs/cosmetica/dcm-2013/dcm132m.pdf
6. Cacoub P, Mussette P, Descamps V, Meyer O, Speirs C, Finzi L, et al. The DRESS Syndrome: A Literature Review. The Am J Med. 2011[acceso: 16/06/2019]; 124(7):588-597. Disponible en: https://www.ncbi.nlm.nih.gov/pubmed/21592453
7. Ghannam M, Mansour S, Nabulsi A. Anticonvulsant hypersensitivity syndrome after phenytoin administration in an adolescent patient: a case report and review of literature. ClinMol Allergy. 2017[acceso: 10/05/2019];15(14):[aprox. 15 p.]. Disponible en: https://clinicalmolecularallergy.biomedcentral.com/articles/10.1186/s12948-017-0069-0
8. Wang F, Li Y, Mo Y, Shen C, Yang L, Zhang X. Cutaneous adverse drug reactions: an 8-year retrospective study on hospitalized patients in Southern China. Indian J Dermatol Venereol Leprol. 2012[acceso: 16/06/2019];78(4):488-90. Disponible en: https://www.ijdvl.com/article.asp?issn=0378-6323;year=2012;volume=78;issue=4;spage=488;epage=490;aulast=Wang
9. Fiszenson-Albala F, Auzerie V, Mahe E, Farinotti R, Durand-Stocco C, Crickx B, et al. A 6-month prospective survey of cutaneous drug reactions in a hospital setting. Br J Dermatol. 2003[acceso: 10/05/2019];149(5):1018-22. Disponible en: https://onlinelibrary.wiley.com/doi/full/10.1111/j.13652133.2003.0558-4.x?sid=nlm%3Apubmed
10. Graña D, Botta C, Núñez M.Síndrome de dress. A propósito de tres casos clínicos y revisión de la literatura. Rev Med Int. 2015[acceso: 10/05/2019]; 37(2):68-73. Disponible en: https://www.scielo.edu.uy/scielo.php?script=sci_arttext&pid=S168-8423X2015000200004
11. Ramos L. Síndrome Dress. Presentación de un caso y actualización. Rev. Argent. Dermatol. 2013[acceso: 10/05/2019]; 94(3):[aprox. 12 p.]. Disponible en: https://rad-online.org.ar/2013/10/01/sindrome-dress-presentacion-de-un-caso-y-actualizacion.
12. Chamorro NA, Avalos ME, Mabel VL. Síndrome de DRESS y Necrólisis Epidérmica Tóxica por el uso de lamotrigina: a propósito de dos casos. Rev Pediatr. 2014[acceso: 10/05/2019]; 41(2):131-138. Disponible en: https://scielo.iics.una.py/scielo.php?script=sci_abstract&pid=S168-398032014000200006&lng=en&nrm=iso&tlng=es
Conflictos de intereses
Los autores no declaran conflictos de intereses.