Artículo de Investigación
Evaluación de examen microscópico directo y su comparación con el método de sedimentación para detectar enteroparásitos
Evaluation of direct microscopic examination and its comparison with sedimentation method for the detection of enteroparasites
Cristina Aldea Gonzales1*
https://orcid.org/0009-0001-1195-8797
Moria
Villca Chuquichambi1
https://orcid.org/0000-0002-9159-9711
Miguel
Angel Condori Sarzuri1
https://orcid.org/0009-0003-6560-4518
Aranza
Rojas Quispe1
https://orcid.org/0009-0005-1929-9350
Camila
Florencia Lopez Villegas1
https://orcid.org/0009-0000-6015-2493
1Universidad Adventista de Bolivia. Facultad de Salud. Cochabamba, Bolivia.
*Autor para la correspondencia. Correo electrónico: cristina.aldea@uab.edu.bo
Introducción:
Los enteroparásitos constituyen un desafío considerable para la salud pública,
en particular en naciones en vías de desarrollo. Estas infecciones, que pueden
provocar problemas serios en grupos vulnerables, necesitan diagnósticos exactos.
Este estudio analiza y contrasta técnicas de diagnóstico que evalúan sensibilidad
y especificidad, con el objetivo de descubrir opciones efectivas y asequibles
en diversos contextos.
Objetivo: Evaluar el examen microscópico directo y comparar con el método
de sedimentación para detectar enteroparásitos.
Métodos: Se realizó un estudio cuantitativo, descriptivo transversal.
Se analizaron 50 muestras fecales por medio del examen microscópico directo
y el método de sedimentación. Los datos se analizaron en SPSS (v.23) para determinar
la sensibilidad y especificidad de ambos métodos, con el método de sedimentación
como prueba de referencia.
Resultados:
El examen microscópico directo detectó parásitos en el 64,0 % de las muestras,
mientras que el método de sedimentación identificó un 72,0 %. Blastocystis
hominis fue el parásito más frecuente en ambas técnicas. La sensibilidad
del examen microscópico directo fue de 80,56 % y especificidad de 78,57 %.
Conclusiones: El método de sedimentación presenta mayor sensibilidad y especificidad en comparación
con el examen microscópico directo, aunque este último es útil en contextos
con recursos limitados. La elección de la técnica diagnóstica debe basarse en
los recursos disponibles y las necesidades del entorno clínico.
Palabras clave: Blastocystis hominis; especificidad; parásitos; salud pública; sedimentación; sensibilidad.
Introduction:
Enteroparasites constitute a considerable challenge to public health, particularly
in developing nations. These infections, which can cause serious problems in
vulnerable groups, require accurate diagnoses. This study analyzes and contrasts
diagnostic techniques that evaluate sensitivity and specificity, with the goal
of discovering effective and affordable options in various contexts.
Objective: To evaluate direct microscopic examination and compare with
the sedimentation method for the detection of enteroparasites.
Methods:
A quantitative, descriptive cross-sectional design was carried out; 50 fecal
samples were analyzed using direct microscopic examination and the sedimentation
method. Data were analyzed in SPSS to determine the sensitivity and specificity
of both methods, using the sedimentation method as a reference.
Results:
Direct microscopic examination detected parasites in 64,0% of the samples, while
the sedimentation method identified 72,0%. Blastocystis hominis was the
most frequent parasite in both techniques. The sensitivity of direct microscopic
examination was 80,56% and its specificity was 78,57%.
Conclusions:
The sedimentation method presents greater sensitivity and specificity compared
to direct microscopic examination, although the latter remains useful in contexts
with limited resources. The choice of diagnostic technique should be based on
the available resources and the needs of the clinical environment.
Keywords: Blastocystis hominis; parasites; public health; sedimentation; sensitivity; specificity.
Recibido: 26/11/2024
Aprobado:
07/07/2025
INTRODUCCIÓN
Las parasitosis son infecciones que generan problemas en la salud pública a escala global. Estas infecciones afectan sobre todo a naciones en vías de desarrollo, debido a factores como un saneamiento insuficiente; aunque también se mantienen en naciones desarrolladas, debido a la movilidad poblacional.(1,2) Las enfermedades causadas por enteroparásitos se pueden presentar de diferentes maneras; la gravedad de los daños ocasionados la determinan elementos como la especie del parásito, la intensidad de la infección, características genéticas e higiene. Una investigación llevada a cabo en Colombia hace énfasis en la importancia de la educación en salud y la implementación de programas de saneamiento para la reducción de enfermedades parasitarias.(1,3,4)
Estas afecciones pueden llevar a complicaciones graves, en mayor medida en grupos vulnerables, lo que resalta la importancia de diagnósticos precisos y a tiempo, para implementar tratamientos adecuados y controlar su propagación.(2)
La Organización Mundial de la Salud (OMS) estima que más de 2 billones de personas en todo el mundo padecen enfermedades causadas por parásitos intestinales. Además, una quinta parte de los países en América Central y Sudamérica está afectada por parásitos como Ascaris lumbricoides, Trichuris trichiura, Ancylostoma spp., Entamoeba histolytica, Giardia lamblia y Blastocystis spp.(3) La OMS subraya la necesidad de realizar diagnósticos precisos, ya que los resultados inexactos pueden incrementar las tasas de morbilidad y mortalidad en la población. Por ello, es fundamental que las pruebas clínicas y de laboratorio cumplan con altos estándares de sensibilidad y especificidad para asegurar la fiabilidad de los resultados.(5)
En la detección de enteroparásitos, se recomienda el examen microscópico directo, dado que posibilita la detección de especies parasitarias en el sistema digestivo humano y simplifica la visualización de trofozoítos móviles.(6) En contraposición, el método de sedimentación rápida formol-éter es adecuada para la concentración de parásitos, pero debido al uso de sustancias químicas tóxicas como el formol, en algunos casos se prefiere el examen microscópico directo.(7,8) La selección del método adecuado dependerá de los materiales e insumos disponibles en el laboratorio, la capacitación del personal, la zona geográfica de procedencia de los pacientes y la especie parasitaria a examinar.(6)
La presente investigación buscó generar evidencia que permita la selección de métodos de diagnóstico eficaces y accesibles, lo cual favorece el progreso en la investigación de salud pública y a la disminución de enfermedades parasitarias en las poblaciones más afectadas.
El objetivo es evaluar el examen microscópico directo y compararlo con el método de sedimentación, para detectar enteroparásitos.
MÉTODOS
Diseño
Se llevó a cabo un estudio observacional, descriptivo y comparativo. El estudio se realizó en el laboratorio de análisis clínico de la carrera de Bioquímica de la Universidad Adventista de Bolivia, ubicado en el municipio de Vinto Cochabamba - Bolivia, durante mayo del año 2024.
Sujetos
La población de estudio estuvo compuesta por pacientes que acudieron al laboratorio de análisis clínico con sospecha de infección de enteroparásitosis. Se incluyeron 50 muestras de heces fecales, seleccionados mediante muestreo no probabilístico por conveniencia. Los criterios de inclusión fueron: pacientes de cualquier edad, que presentaran signos y síntomas compatibles con enteroparásitosis y que aceptaron participar en el estudio, mediante la firma de un consentimiento informado. Se excluyeron a pacientes con tratamiento antiparasitario y muestras contaminadas.
Variables
Se comparó la sensibilidad, especificidad, valor predictivo positivo y valor predictivo negativo de ambos métodos. La sensibilidad se definió como la capacidad de cada método para detectar casos positivos de enteroparásitos, mientras que la especificidad se midió como la capacidad de cada método para identificar de forma correcta las muestras negativas.
Procedimientos
Se obtuvieron muestras de heces frescas de cada paciente, mediante el uso de recipientes estériles. Las muestras fueron procesadas dentro de las dos horas posteriores a su recolección para asegurar la integridad de los parásitos. Las muestras se analizaron por el método directo y el de sedimentación, siguiendo los procedimientos de cada técnica.
Examen microscópico directo
Se utilizó una laminilla de portaobjeto, con una pipeta Pasteur; se colocó una gota de suero fisiológico en un extremo del portaobjetos y una gota de lugol en el otro extremo. Luego, con un palillo aplicador, se tomó una pequeña cantidad de la muestra de heces del frasco de plástico y se mezcló con las gotas de suero fisiológico y lugol. Se procedió a cubrir el preparado con un cubreobjetos y se observó al microscopio con objetivos de 10x y 40x.(8)
Método de sedimentación
Para el método de sedimentación se homogeneizaron 2 g de la muestra de heces, con 2,5 mL de suero fisiológico en un tubo de ensayo. Después de homogeneizar la muestra de heces se filtró con la ayuda de un tamiz de malla fina, colocado en un embudo de vidrio sobre un tubo cónico; esto permitió separar los residuos sólidos. Para el siguiente paso se agitó el tubo cónico durante 15 segundos y se dejó reposar por 30 minutos. Tras el periodo de sedimentación se descartó con cuidado el sobrenadante, con una pipeta Pasteur se aspiró el sedimento y se depositó una gota sobre una lámina de portaobjeto limpia; se agregó una gota de lugol, se cubrió el preparado con una laminilla de cubreobjeto y finalmente se observó en el microscopio con un objetivo de 40x.(9)
Procesamiento
Los datos obtenidos de ambos métodos coproparasitológicos se registraron en un cuaderno de resultados; se analizaron con el software estadístico SPSS v.23. Se calcularon frecuencias absolutas y relativas de los tipos de parásitos. Para comparar los métodos, se determinó la prueba de ji cuadrado de Pearson, para la relación de ambos métodos y se consideró un valor de p< 0,05 como significativo. Se elaboró una tabla de 2x2 para calcular la sensibilidad y especificidad del método evaluado y a su vez se calcularon los índices de concordancia (kappa de Cohen); la interpretación de los valores del índice kappa se basó en las recomendaciones Landis y Koch:(10) concordancia se califica como pobre o débil cuando los valores son menores de 0,40; moderada para valores de entre 0,41 y 0,60; buena entre 0,61 y 0,80; y muy buena valores superiores, hasta 1, entre las pruebas del examen microscópico directo y el método de sedimentación.
Cuestiones bioéticas
La presente investigación se basó en los Principios de Helsinki, que garantizan la confidencialidad de los datos al excluir la información de identificación siempre que sea posible y utilizar códigos en lugar de nombres reales al transcribir datos, para proteger la confidencialidad y los derechos de cada paciente. Se obtuvo la aprobación del Comité de Ética y las autoridades sanitarias de la institución, cuya evidencia se aporta.
RESULTADOS
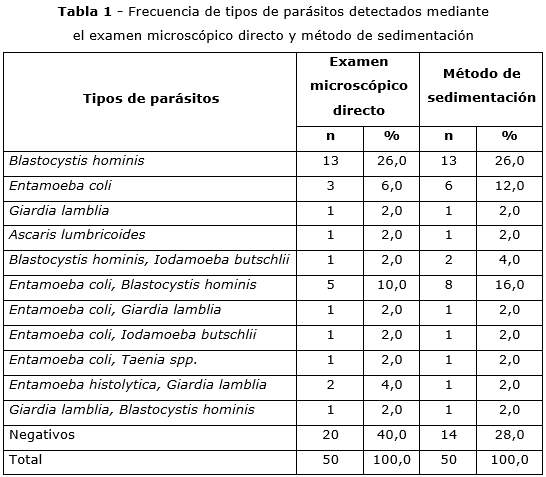
De las 50 muestras analizadas por el examen microscópico directo, el 64,0 % resultaron positivos y 36,0 % negativos. Por otro lado, las muestras analizadas por método de sedimentación obtuvieron 72,0 % de resultados positivos y 28,0 % negativos. El parásito detectado con mayor frecuencia en ambos métodos fue Blastocystis hominis, con 26,0 % en ambos métodos, seguidos por Entamoeba coli, con 6,0 % y 12,0 %. Entre los biparasitados, con mayor frecuencia fueron Entamoeba coli y Blastocystis hominis, con 10,0 % en el método de examen microscópico directo y 16,0 % en el método de sedimentación (tabla 1).
En cuanto a la comparación de los métodos parasitológicos; el de sedimentación detectó 72,0 % de resultados positivos y 28,0 % de resultados negativos. Sin embargo, el examen microscópico directo detectó 64,0 % de resultados positivos y 36,0 % de resultados negativos. Según los valores de ji cuadrado de Pearson, existió relación significativa entre ambos métodos (p= 0,00) y una concordancia moderada, con un coeficiente kappa de 0,54 (tabla 2).
Los indicadores diagnósticos del examen microscópico directo, respecto al método de sedimentación, presentó una sensibilidad de 80,56 % y una especificidad de 78,57 % (tabla 3).
DISCUSIÓN
El análisis de las técnicas coproparasitológicas en la detección de enteroparásitos revela importantes diferencias, en términos de sensibilidad y especificidad, lo que impacta en la precisión diagnóstica. En este estudio, de las 50 muestras analizadas mediante examen microscópico directo, el 64,0 % resultaron positivas, con Blastocystis hominis como el parásito más común de un 26,0 %, seguido de Entamoeba coli de 6,0 %. Este método, aunque sencillo y económico, presentó una sensibilidad del 80,56 % y una especificidad del 78,57 %, que lo hace útil en áreas con recursos limitados, pero menos efectivo, comparado con métodos más avanzados.
Al comparar los métodos se encontró que el de sedimentación mostró un mayor rendimiento, con un 72,0 % de resultados positivos, en línea con lo reportado por estudios previos, como el de Terashima A. y otros(11) y Amarildo F. y otros,(6) quienes confirmaron su alta sensibilidad y especificidad. Rosales J. y otros,(12) asimismo corroboran estos hallazgos, destacan una sensibilidad del 100 % para identificar infecciones por protozoos. Estos resultados subrayan la importancia de la sedimentación en la detección precisa de enteroparásitos, en contextos que requieren mayor precisión diagnóstica.
El método de Ritchie, con una sensibilidad del 95 %, según Alonso J. y otros,(8) mostró ser efectivo para la detección de parásitos, aunque algunos estudios, como el de Salvador F. y otros,(13) encontraron que el examen microscópico directo es más sensible para detectar Blastocystis sp. Esto sugiere que, aunque Ritchie es muy eficaz, su efectividad puede variar según el tipo de parásito y las condiciones del estudio.
El estudio de Silva J. y otros(14) reportó una sensibilidad del 97,2 % para la técnica de sedimentación espontánea en tubo, con un coeficiente de concordancia kappa de 0,829 en comparación con la técnica de Ritchie; subraya la robustez de ambos métodos en la práctica diagnóstica.
No obstante, es crucial mencionar las limitaciones de cada técnica. Mientras que el examen microscópico directo es rápido y económico, puede resultar en falsos positivos y tiene menor sensibilidad para algunos parásitos. Por otro lado, el método de sedimentación, aunque más preciso, puede ser menos práctico, debido a sus requerimientos de tiempo y recursos. El método de Ritchie, aunque presenta una elevada sensibilidad, puede no ser viable en todos los entornos debido a su complejidad operativa.(15)
Los estudios aquí revisados mostraron una moderada concordancia entre los métodos, con un coeficiente kappa de 0,54 entre el examen microscópico directo y el método de sedimentación, según los valores de ji cuadrado de Pearson, existe una relación significativa entre ambos métodos (p= 0,00). Además, la sedimentación rápida, como reportada por Amarildo F. y otros(12) presentó altos índices de sensibilidad y especificidad, lo que resalta su efectividad en el diagnóstico de parásitos.
En conclusión, la selección de la técnica coproparasitológica se toma en cuenta tanto el contexto clínico como los recursos disponibles. En muchos hospitales, en los cuales el acceso a materiales y reactivos es limitado, el examen microscópico directo puede ser una opción viable debido a su simplicidad. Sin embargo, cuando se cuenta con los recursos adecuados, las técnicas de sedimentación y el método de Ritchie son preferibles, ya que ofrecen una mayor sensibilidad y especificidad en la detección de parásitos. Esto subraya la importancia de adaptar las prácticas diagnósticas a las capacidades de cada entorno para mejorar los resultados en salud pública.
Agradecimientos
Agradecemos a la Universidad Adventista de Bolivia por permitir realizar esta investigación; asimismo, extendemos nuestra gratitud a todos los miembros de la Sociedad Estudiantil de Investigación Bioquímica por su valiosa contribución en cada etapa del proceso. Su colaboración y compromiso fueron fundamentales para la realización de este trabajo y demuestra el valor del esfuerzo colectivo en la investigación científica.
REFERENCIAS BIBLIOGRÁFICAS
1.Catrileo Daniela L, Zulantay Alfaro I, Apt Baruch W, Canals Lambarri M. Mortalidad por parasitosis endémicas e importadas en Chile [Internet]. Rev chil infectol. 2022 [acceso: 13/07/2024]; 39(2): 138-48. Disponible en: http://www.scielo.cl/scielo.php?script=sci_arttext&pid=S0716-10182022000200138&lng=es
2.Villca Chuquichambi M, Vargas Madrid D. Prevalencia de parásitos intestinales en pacientes que acudieron al laboratorio Laboclin S.R.L [Internet]. Revista UNITEPC. 2023 [acceso: 10/08/2024]; 10(2): 36-43. Disponible en: http://www.scielo.org.bo/scielo.php?script=sci_arttext&pid=S2520-98252023000200036&lng=es
3. Aldea Gonzales C, Villca Chuquichambi M, Ontiveros Oporto J, Vargas Mamani S, Rubén Darío Ríos Cruz. Frecuencia de la enteroparasitosis y factores de riesgo asociados en manipuladores de alimentos en el Municipio de Vinto, Cochabamba, Bolivia [Internet]. Revista De Investigación E Información En Salud. 2024; 9(47): 50-58. DOI: https://doi.org/10.52428/20756208.v19i47.1182
4. Ayele A, Tegegne Y, Derso A, Eshetu T, Zeleke AJ. Prevalence and associated factors of intestinal helminths among kindergarten children in Gondar town, northwest Ethiopia [Internet]. Pediatric Health Med Ther. 2021 [acceso: 13/07/2024]; 12:35-41. Disponible en: https://www.dovepress.com/prevalence-and-associated-factors-of-intestinal-helminths-among-kinder-peer-reviewed-fulltext-article-PHMT
5. Villacreses LL, Gonzalez Vera L. Vista de Aplicación, cálculo e importancia de la sensibilidad, especificidad y valor predictivo de las pruebas de diagnóstico en el laboratorio clínico [Internet]. Ciencias de la Salud. 2021 [acceso:13/07/2024]; 10: e23857. Disponible en: https://dialnet.unirioja.es/descarga/articulo/8229763.pdf
6. Carrasco Solano F, Santa Cruz López C, Vergara Espinoza M, Sánchez Fernandez M. Comparación de técnicas coproparasitológicas para el diagnóstico de geohelmintos intestinales en niños Lambayecanos [Internet]. Gac Med Bol. 2023 [acceso: 13/07/2024]; 46(1): 72-6. Disponible en: http://www.scielo.org.bo/scielo.php?script=sci_arttext&pid=S1012-29662023000100072&lng=es
7. Demeke G, Fenta A, Dilnessa T. Evaluation of wet mount and concentration techniques of stool examination for intestinal parasites identification at Debre Markos comprehensive specialized hospital, Ethiopia [Internet]. Infect Drug Resist. 2021 [acceso: 13/07/2024];14: 1357-62. Disponible en: https://www.dovepress.com/evaluation-of-wet-mount-and-concentration-techniques-of-stool-examinat-peer-reviewed-fulltext-article-IDR
8. Alonso Rosales R, Bautista Manchego K. Comparación de tres métodos de concentración de enteroparásitos en muestras fecales humanas [Internet]. Rev Cubana Med Trop. 2020 [acceso: 13/07/2024 ]; 72(2): 2-4. Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0375-07602020000200008&lng=es
9. Gonzales Espino KI. Técnica de sedimentación simple versus microtécnica de sedimentación en la identificación de parasitosis intestinales en pacientes del centro de salud del distrito de Pueblo Nuevo, Ica 2018 [Internet]. [Tesis de pregrado]. Perú: Universidad de Alas Peruanas; 2019. [acceso: 27/07/2024]. Disponible en: https://repositorio.uap.edu.pe/bitstream/handle/20.500.12990/8907/Tesis_T%C3%A9cnica_Sedimentaci%C3%B3n_Simple.pdf?sequence=1&isAllowed=y
10. Cortes Reyes E, Rubio Romero J, Gaitan Duarte H. Vista de Métodos estadísticos de evaluación de la concordancia y la reproducibilidad de pruebas diagnósticas. (s/f) [Internet]. Rev Colomb de obstetricia y ginecología. 2010 [acceso: 22/10/2024]; 61(4):e18597. Disponible en: https://revista.fecolsog.org/index.php/rcog/article/view/271/276
11. Terashima A, Marcos L, Maco V, Canales M, Samalvides F, Tello R, et al. Técnica de sedimentación en tubo de alta sensibilidad para el diagnóstico de parásitos intestinales [Internet]. Rev Gastroenterol Perú. 2009 [acceso: 05/05/2024]; 29(4):305-10. Disponible en: http://www.scielo.org.pe/scielo.php?script=sci_arttext&pid=S1022-51292009000400002
12. Jaime Alonso R, Bautista K. Comparación de tres métodos de concentración de enteroparásitos en muestras fecales humanas [Internet]. Revista Cubana de Medicina tropical. 2020 [acceso: 05/05/2024]; 72 (2): 497. Disponible en: http://scielo.sld.cu/scielo.php?script=sci_abstract&pid=S0375-07602020000200008
13. Salvador F, Goterris L, Sulleiro E, López I, Balladares M, et al. Microscopic examination after concentration techniques for Blastocystis sp. detection in serial faecal samples: How many samples are needed? [Internet]. Parasite Epidemiol Control. 2020 [acceso: 06/09/2024]; 9:e00137. Disponible en: https://pubmed.ncbi.nlm.nih.gov/32055721/
14. Quispe S, Cesar J. Técnica de sedimentación espontánea en tubo para diagnóstico de enteroparasitosis en centros de salud de primer nivel [Internet]. Rev médica - Col Méd Paz. 2017 [acceso: 26/08/2024]; 23(2):13-9. Disponible en: http://www.scielo.org.bo/scielo.php?script=sci_arttext&pid=S1726-89582017000200003
15. Utzinger J, Becker SL, van Lieshout L, van Dam GJ, Knopp S. New diagnostic tools in schistosomiasis [Internet]. Clin Microbiol Infect. 2015 [acceso: 06/09/2024]; 21(6):529-42. Disponible en: https://pubmed.ncbi.nlm.nih.gov/25843503/
Conflictos de interés
Los autores declaran que no existen conflictos de interés.
Información financiera
Se encuentra financiado en su totalidad por la Universidad Adventista de Bolivia.
Contribuciones de los autores
Conceptualización: Cristina Aldea Gonzales, Moria Villca Chuquichambi, Miguel
Angel Condori Sarzuri, Aranza Rojas Quispe, Camila Florencia Lopez Villegas.
Curación
de datos: Cristina Aldea Gonzales, Moria Villca Chuquichambi, Camila Florencia
Lopez Villegas.
Análisis
formal: Cristina Aldea Gonzales, Moria Villca Chuquichambi.
Investigación:
Cristina Aldea Gonzales, Moria Villca Chuquichambi, Miguel Angel Condori
Sarzuri, Aranza Rojas Quispe, Camila Florencia Lopez Villegas.
Metodología:
Cristina Aldea Gonzales, Moria Villca Chuquichambi, Miguel Angel Condori
Sarzuri.
Software:
Moria Villca Chuquichambi.
Administración
del proyecto: Cristina Aldea Gonzales.
Recursos:
Cristina Aldea Gonzales, Miguel Angel Condori Sarzuri.
Supervisión:
Cristina Aldea Gonzales, Moria Villca Chuquichambi, Aranza Rojas Quispe.
Disponibilidad de datos
Los datos de esta investigación son confidenciales de acuerdo con los acuerdos y regulaciones de confidencialidad aplicables y, por lo tanto, no pueden mostrarse ni compartirse públicamente. Los datos se almacenan de forma segura en la Sociedad Estudiantil de Investigación Bioquímica de la Universidad Adventista de Bolivia. El acceso a estos datos requiere la autorización adecuada. Si tiene alguna pregunta o necesita más información, comuníquese con Moria Villca Chuquichambi en moria.villca@uab.edu.bo.