Artículo de Investigación
Evaluación preliminar de Jusvinza como terapia inmunomoduladora en el síndrome de Guillain Barré
Preliminary evaluation of Jusvinza as an immunomodulatory therapy in Guillain Barré syndrome
Raúl Santana Sánchez1 https://orcid.org/0000-0002-5761-1393
Anabel Serrano Díaz2 https://orcid.org/0000-0002-8301-5771
Rubén Peña Ruiz1 https://orcid.org/0000-0002-4204-1084
Mabel Hernández-Cedeño2 https://orcid.org/0000-0002-6162-7160
Gillian Martínez-Donato2 https://orcid.org/0000-0002-7797-4255
Rafael Venegas Rodríguez1 https://orcid.org/0000-0001-5956-6672
María del Carmen Domínguez Horta2* https://orcid.org/0000-0002-0616-7376
1Hospital Militar Central “Dr. Luis Díaz Soto”. La Habana, Cuba.
2Centro de Ingeniería Genética y Biotecnología. La Habana, Cuba.
*Autor para la correspondencia. Correo electrónico: mcarmen.dominguez@cigb.edu.cu
RESUMEN
Introducción: El síndrome de Guillain-Barré (SGB) es una polineuropatía inflamatoria aguda, cuya fisiopatología se basa en el daño del sistema nervioso periférico por componentes del sistema inmunológico. Jusvinza es un fármaco inmunomodulador empleado en pacientes con artritis reumatoide y COVID-19. La acción antiinflamatoria de Jusvinza respalda su uso potencial en enfermedades como el SGB.
Objetivos: Evaluar el efecto terapéutico y la seguridad de Jusvinza en el tratamiento del SGB.
Métodos: Se incluyeron 13 pacientes diagnosticados con SGB asociado principalmente a infecciones respiratorias; 11 recibieron Jusvinza, a una dosis de 1 mg cada 8 horas por vía i.v., mientras que los 2 restantes se trataron con la terapia estándar. Se documentó en las historias clínicas la evolución clínica, el tiempo de recuperación, la duración de la estancia en la unidad de cuidados intensivos (UCI), los eventos adversos y el estado al egreso. Posteriormente, estos datos fueron organizados y analizados mediante tablas comparativas.
Resultados: Jusvinza redujo en promedio los tiempos de recuperación y estancia en la UCI en 18 y 27 días, respectivamente, en comparación con las inmunoterapias estándar. No se registraron afecciones respiratorias ni otras complicaciones; tampoco se observaron efectos adversos graves asociados al tratamiento. Todos los pacientes evolucionaron favorablemente y fueron dados de alta
Conclusiones: Jusvinza induce una mejoría rápida en los pacientes con el SGB, con buen perfil de seguridad, lo que representa un punto de partida para investigaciones futuras.
Palabras clave: inflamación; Jusvinza; pacientes; síndrome de Guillain-Barré.
ABSTRACT
Introduction: Guillain-Barré Syndrome (GBS) is an acute inflammatory polyneuropathy characterized by immune-mediated damage to the peripheral nervous system. Jusvinza is an immunomodulatory drug previously administered to patients with rheumatoid arthritis and COVID-19. Its anti-inflammatory properties support its potential therapeutic application in conditions such as GBS.
Objectives: To evaluate the therapeutic effect and safety of Jusvinza in the treatment of GBS.
Methods: Thirteen patients diagnosed with GBS, primarily associated with respiratory infections, were enrolled following informed consent. Eleven patients received intravenous Jusvinza at a dosage of 1 mg every 8 hours, while the remaining two were treated with standard therapy. Clinical progression, recovery time, duration of stay in the intensive care unit (ICU), adverse events, and discharge status were documented in medical records. These data were subsequently organized and analyzed using comparative tables.
Results: Jusvinza reduced the average recovery time and ICU stay by 18 and 27 days, respectively, compared to standard immunotherapies. No respiratory complications or other adverse events were reported, and no serious side effects were associated with the treatment. All patients showed favorable clinical outcomes and were discharged.
Conclusions: Jusvinza promote rapid clinical improvement in patients with GBS and demonstrated a favorable safety profile, representing a promising starting point for future research.
Keywords: Guillain-Barré syndrome; inflammation; Jusvinza; patients.
Recibido: 17/07/2025
Aprobado: 27/08/2025
INTRODUCCIÓN
El síndrome de Guillain-Barré (SGB) es una polineuropatía desmielinizante inflamatoria aguda, mediada por el sistema inmunitario, que compromete los nervios responsables del movimiento muscular y de la transmisión de las señales térmicas, táctiles y de dolor. Es un trastorno poco frecuente. Se estima que cada año se diagnostican alrededor de 100 000 personas con esta enfermedad. La incidencia aumenta con la edad y es ligeramente superior en hombres.(1)
En el SGB ocurre una desmielinización y daño axonal, mediados por anticuerpos cros-reactivos, el complemento y células T autorreactivas. En la generación de estos anticuerpos desempeña un papel clave el mimetismo molecular, entre los lipo-oligosacáridos de las membranas externas bacterianas y los gangliósidos de las membranas periféricas axonales. Los anticuerpos son capaces de atacar diferentes nervios periféricos, lo cual explica la heterogeneidad en la manifestaciones clínicas del SGB.(2) Este mecanismo puede estar mediado por el complemento. Existen evidencias de que la deposición de C3 en los nodos de Ranvier y las regiones paranodales, promueve el ataque de anticuerpos antigangliósidos tipo IgG, afecta los canales de sodio y la interacción axón-células de Schawnn. El complemento, por sí solo, se considera que también podría provocar daños en las regiones nodales y paranodales.(3,4)
Se conoce poco sobre el papel específico de los macrófagos en la desmielinización axonal; no obstante, se sabe que estos secretan citocinas proinflamatorias y llevan a cabo la fagocitosis, mediante mecanismos que pueden ser dependientes o independientes del complemento. Se postula que, los macrófagos residentes en el sistema nervioso periférico actúan como células presentadoras de antígeno y como tal, desencadenan la cascada inflamatoria y promueven la migración de monocitos circulantes hacia el sitio del daño. Estos monocitos, una vez en el tejido afectado, se diferencian en macrófagos, lo que intensifica el daño axonal. De manera similar, también se ha observado infiltración linfocitaria en estas regiones.(5,6)
La desmielinización parcial o total de los axones interrumpe la conducción nerviosa. Esto provoca debilidad muscular, parestesias y dolor, respectivamente.(7)
Los tratamientos para el SGB están destinados a disminuir la gravedad de los síntomas y acortar su duración. Durante la fase aguda (primeras cuatro semanas), comúnmente se recurre a terapias inmunomoduladoras. Entre las más utilizadas se encuentran las inmunoglobulinas intravenosas (ej., Intacglobin), que se consideran eficaces para mitigar el ataque del sistema inmunitario al sistema nervioso, y la plasmaféresis, cuyo objetivo es eliminar los anticuerpos circulantes que contribuyen al daño.(7)
Jusvinza es un fármaco inmunomodulador, desarrollado en el Centro de Ingeniería Genética y Biotecnología (CIGB), para el tratamiento de enfermedades autoinmunes, como la artritis reumatoide (AR).(8) Durante la pandemia de COVID-19, su uso se extendió a las unidades de cuidados intensivos (UCI) en gran parte de Cuba, específicamente para el manejo del síndrome de distrés respiratorio agudo (SDRA) asociado a esta enfermedad. Durante ese período se observó, de manera directa, la mejoría de pacientes graves y críticos con hiperinflamación, a partir de las 48 horas de iniciado el tratamiento. Esta mejoría se reflejó en parámetros clínicos relacionados con la inflamación y la coagulación, así como en la estabilización de los signos vitales, la reducción de la necesidad de ventilación, del tiempo de hospitalización y aumento de la tasa de supervivencia.(9,10,11)
El presente estudio tiene como propósito evaluar el efecto terapéutico y el perfil de seguridad de Jusvinza en pacientes con SGB.
MÉTODOS
Diseño
Se ejecutó un estudio exploratorio, observacional, abierto y no controlado. Se incluyeron 13 pacientes; de ellos, siete se atendieron en la UCI del Hospital Militar Central “Dr. Luis Díaz Soto”, en el período de abril a septiembre de 2024. Los seis restantes pacientes, son pacientes cubanos, que se atendieron en sus misiones médicas, en México y Venezuela, desde junio de 2020 hasta febrero de 2021.
Para el diagnóstico del SGB se usaron los criterios diagnósticos de Brighton,(11) para el diagnóstico del SGB, que incluyen:
Debilidad muscular bilateral y flácida en extremidades.
Hiporreflexia o arreflexia en extremidades débiles.
Patrón de enfermedad monofásico.
Inicio de la debilidad: 12 horas − 28 días + meseta subsecuente.
Disociación albúmino-citológica (elevación de proteínas asociado a una celularidad < 50 células/mm3) en líquido cefalorraquídeo (LCR).
Hallazgos electrofisiológicos consistentes con SGB.
Ausencia de un diagnóstico alternativo identificado de la debilidad.
Los cuatro primeros criterios diagnósticos se establecieron mediante examen físico; para el quinto criterio se realizó una punción lumbar, en la segunda semana desde la aparición de los síntomas. A siete pacientes se les realizó en la primera semana y se les repitió en la segunda, para obtener resultados confirmatorios. El estudio electrofisiológico consistió en la evaluación de la neuroconducción, en al menos tres nervios sensitivos y cuatro motores, así como en la medición de las ondas F y el reflejo H mediante electromiografía de aguja.
Sujetos
Criterios de inclusión:
Pacientes con criterio diagnóstico de SGB.
De 19 años de edad o más.
Conformidad del paciente, familiar o representante legal, a través de la firma del consentimiento informado.
Criterios de exclusión:
Pacientes con orden de no reanimación.
Participantes incluidos en otro ensayo clínico en el momento de la inclusión.
Pacientes con uso compasivo de Jusvinza en el momento de la inclusión.
Pacientes con una enfermedad en fase terminal.
Pacientes con hipersensibilidad al producto o sus componentes.
Los investigadores documentaron detalladamente en las historias clínicas, la información relevante para dar seguimiento a la evolución de los pacientes.
Variables y procedimientos
Los pacientes recibieron atención médica conforme a los protocolos clínicos vigentes, que incluyeron medidas de soporte y tratamiento convencional según la gravedad de los síntomas. La administración de Jusvinza se integró como intervención complementaria.
Se recopilaron las variables demográficas (edad, sexo), la clasificación clínica del SGB, las comorbilidades asociadas, los resultados de pruebas de laboratorio, las imágenes radiográficas de tórax y los desenlaces clínicos. Las variables principales de evaluación fueron:
Tiempo de recuperación de los signos y síntomas clínicos atribuibles al SGB.
Duración total de la estancia en UCI.
Evolución clínica durante el tratamiento.
Aparición de eventos adversos relacionados con la administración de Jusvinza.
Estado clínico del paciente al momento del egreso hospitalario.
Los datos obtenidos se organizaron en matrices de análisis utilizando Microsoft Excel, lo que permitió la elaboración de tablas comparativas y la evaluación sistemática de los resultados clínicos.
Exposición a Jusvinza
Jusvinza se administró por vía i.v., a una dosis de 1 mg cada 8 horas y el tratamiento se prolongó hasta la resolución de la parestesia muscular. En los casos de pacientes que ya estaban recibiendo Intacglobin al momento de su inclusión, se esperó 8 horas antes de la primera dosis de Jusvinza. Para los pacientes en tratamiento con plasmaféresis, se esperó un intervalo de 2 horas.
Consideraciones éticas
El protocolo fue revisado y discutido por especialistas del CIGB y del hospital ejecutante, antes del comienzo del estudio. La investigación se realizó en concordancia con los principios éticos para la investigación médica con sujetos humanos, establecidos en la actualización de la Declaración de Helsinki,(12) y en correspondencia con las regulaciones vigentes en Cuba. Además, el Comité de Ética del hospital aprobó el estudio. El consentimiento informado por escrito del familiar o representante legal fue determinante, debido a la gravedad de los pacientes, sin embargo, cuando la condición clínica lo permitió, los pacientes se informaron sobre los detalles del estudio, sus derechos a interrumpir la participación y la necesidad de otorgar el consentimiento explícito para continuar.
Los datos de seguridad de los pacientes se recolectaron de acuerdo a la Resolución 45/2007 de la Autoridad Reguladora de Cuba.(13) Se monitorearon exhaustivamente los eventos adversos y fueron recopilados en las historias clínicas.
RESULTADOS
Características demográficas
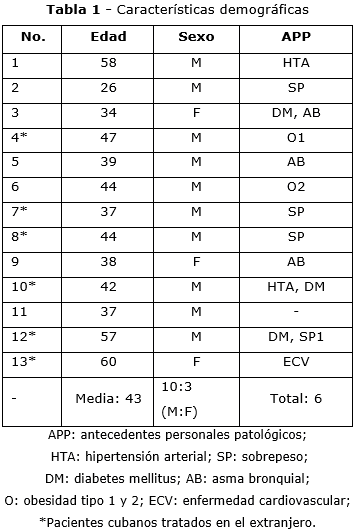
Las características demográficas y los antecedentes patológicos personales de los pacientes se presentan en la tabla 1.
La mayoría de los pacientes con diagnóstico de SGB incluidos en el estudio, fueron hombres jóvenes; solo se incluyeron tres mujeres. Las edades oscilaron entre los 26 y los 60 años; la edad promedio fue de 43 años. La mayoría de los pacientes, además, tenían al menos una comorbilidad; las más frecuentes fueron la diabetes mellitus, el sobrepeso y la obesidad.
Criterios diagnósticos y terapéutica de la enfermedad
En los 13 pacientes, el agente desencadenante del SGB fue de tipo infeccioso. La mayoría cursó por infecciones respiratorias y gastrointestinales previas (tabla 2); siendo las más frecuentes, del primer tipo. Hubo un paciente con una infección urinaria previa y dos cuya etiología no se pudo establecer de manera clara. Como promedio, entre las infecciones previas y la aparición de los síntomas del SGB, pasaron 15 días.
En el análisis del LCR, excepto en dos pacientes, no se obtuvieron resultados concluyentes del diagnóstico hasta la segunda semana. En la mayoría de los casos se observó el patrón típico de disociación albúmino-citológica en el LCR. La prueba de neuroconducción confirmó el diagnóstico de la variante clásica de la enfermedad.
Todos los pacientes recibieron la terapia básica de vitaminoterapia y rehabilitación precoz. Once de ellos fueron tratados con Jusvinza, y los dos restantes se mantuvieron recibiendo plasmaféresis, en un caso, e Intacglobin en el otro caso.
Evolución de la enfermedad y estado al egreso
Solo el paciente que se mantuvo recibiendo plasmaféresis y no recibió tratamiento con Jusvinza, progresó al SDRA y requirió ventilación mecánica invasiva (tabla 3).
El tiempo promedio de estadía en la UCI, con criterio de gravedad, en los pacientes tratados con Jusvinza, fue de 19 días. En cambio, el paciente tratado con Intacglobin estuvo 32 días y el que recibió plasmaféresis, 60 días. En correspondencia, el tiempo de recuperación hospitalaria de los pacientes tratados con Jusvinza, también fue menor. No se registraron eventos adversos asociados con el tratamiento, todos los pacientes se recuperaron y recibieron alta hospitalaria.
DISCUSIÓN
La etiología del SGB no se ha esclarecido totalmente. Existen múltiples resultados contradictorios en la literatura, sin embargo, se ha documentado que el proceso inflamatorio y la desregulación inmune desempeñan un papel clave en su desarrollo.(2,3,5,6) Como evidencia, se ha observado un incremento en la migración de monocitos/macrófagos y linfocitos Th1 y Th17 hacia el sistema nervioso periférico.(5,14) Además, se han reportado daños provocados por autoanticuerpos, dirigidos contra gangliósidos y proteínas de la mielina, como consecuencia del mimetismo molecular, el papel del complemento como mediador del daño inducido por los autoanticuerpos y los macrófagos, así como el daño directo ejercido por estos últimos.(3,6)
Se ha descrito también un aumento en la secreción de citocinas inflamatorias, tales como IFN-γ, TNF-α, IL-1β, IL-6, IL-2, IL-17 e IL-22.(2) Reportes más recientes han señalado, además, una disminución de los linfocitos T reguladores (Treg) y de su actividad durante la fase aguda de la enfermedad.(14)
Jusvinza tiene como ingrediente activo un péptido inmunorregulador derivado de la proteína de estrés celular HSP60. Esta proteína aumenta su concentración durante las infecciones virales. Diferentes grupos de investigadores le han adjudicado un papel en la regulación de la respuesta inmunitaria,(7) en cambio, se ha demostrado en varios modelos experimentales in vitro y en ensayos preclínicos, que el tratamiento con Jusvinza induce mecanismos reguladores de la inflamación: Incrementa la frecuencia y actividad de los linfocitos Treg y disminuye los niveles de las citocinas proinflamatorias como el TNFα e IL-17.(15,16,17) Asimismo, a través de estudios de proteómica, con células mononucleares de la sangre periférica y neutrófilos de pacientes con AR, se comprobó que el péptido incide sobre la actividad de neutrófilos, monocitos, macrófagos y atenúa los eventos inflamatorios que median dichas células.(18,19)
Por otra parte, en un ensayo clínico fase I en AR se evidencia la disminución de la actividad clínica de la enfermedad; se reduce la sinovitis y el edema en las manos, así como las citocinas inflamatorias IL-17 e IFNγ.(16) En un ensayo clínico fase II (resultados aún no publicados) se evidencia mejoría significativa, con menor dosis y nuevamente hay reducción de la actividad de la enfermedad y de la citocina IL-6.
Con el reposicionamiento de Jusvinza para el tratamiento de la hiperinflamación característica en pacientes graves y críticos con la COVID-19, se evidencia mejoría gasométrica y radiológica, desde las primeras 48 horas de iniciar el tratamiento.(9) Los parámetros de laboratorio indican que, durante el curso del tratamiento con Jusvinza se normalizan los niveles de linfocitos y neutrófilos.(9,20) Asimismo, se observa normalización en biomarcadores asociados con la hiperinflamación, como la proteína C reactiva, la ferritina, la lactato deshidrogenasa, el índice neutrófilo/linfocitos y la eritrosedimentación. También se regulan los biomarcadores de coagulación, como el fibrinógeno y el dímero D(10,11,20,21) y disminuyen las concentraciones de citocinas asociadas a la tormenta de citocinas, incluyendo IL-6, TNF-α, IL-17 e IL-10. De igual forma, se reducen proteínas asociadas a la inflamación, como la calprotectina, la granzima B y la perforina.(20)
Los pacientes con hiperinflamación relacionada con la COVID-19 presentaban, en su mayoría, múltiples comorbilidades, como hipertensión arterial, diabetes mellitus, cáncer, obesidad, sobrepeso e insuficiencia renal crónica en diálisis, entre otras. Estos pacientes solían desarrollar SDRA, colapso cardiovascular y fallo multiorgánico, complicaciones que comúnmente conducían a un desenlace fatal. No obstante, el tratamiento con Jusvinza logró revertir este escenario adverso, mejorar significativamente la evolución clínica y el pronóstico.(10,11)
Recientemente, el efecto antiinflamatorio de Jusvinza se estudió en un modelo animal, con peces cebra en estado embriogénico y en adultos; tratados con N-carboximetillisina (CML). Esta molécula afecta el desarrollo embriogénico de los peces cebra, específicamente del tubo neural; en lo adultos induce hiperinflamación, con parálisis, afectación de la capacidad de nado y muerte.(22) En estos estudios, el efecto antiinflamatorio de Jusvinza se comparó con el de los anticuerpos monoclonales comerciales: Infliximab (anti-TNF) y Tocilizumab (anti-IL-6). Los resultados indican que el tratamiento con Jusvinza neutraliza la toxicidad de la CML y evita los daños de los embriones en el tubo neural, así como la muerte. En los peces adultos disminuye la inflamación y la parálisis. Además, reduce la migración de los neutrófilos y los niveles de IL-6 en el tejido hepático. Estos efectos son significativamente superiores al Infliximab y similares al Tocilizumab.(23,24,25)
Los resultados en estos tres contextos inflamatorios, distintos en cuanto a la etiología, pero similares en las dinámicas y respuestas a moleculares y celulares, refuerzan las potencialidades de Jusvinza para el tratamiento de enfermedades inflamatorias agudas y crónicas. Además, sugieren su posible utilidad en el abordaje de enfermedades neurodegenerativas.
La plasmaféresis y el Intacglobin constituyen componentes fundamentales de la terapia estándar para el tratamiento del SGB. Su acción se centra en reducir el número de autoanticuerpos circulantes y neutralizar su actividad.(26,27) Sin embargo, estas terapias no abordan de manera integral otros mecanismos inmunopatológicos que contribuyen al daño en el SGB. En este contexto, Jusvinza podría representar una alternativa terapéutica superior, pues tiene el potencial de disminuir el reclutamiento de monocitos y macrófagos, al tiempo que aumenta la población y actividad de los linfocitos T reguladores (Treg), los que ejercen un efecto supresor sobre la proliferación de células Th1 y Th17, así como sobre la secreción de citocinas inflamatorias.(28) De esta manera pudiera regular la respuesta autoinmunitaria aguda, inducida por el mimetismo molecular y la consiguiente reactividad cruzada entre los lipo-oligosacáridos bacterianos y los gangliósidos neuronales, así como inhibir la lesión en los nervios periféricos Ello contribuiría a restablecer la homeostasis inmunológica en los pacientes.
En cuanto a la seguridad, la plasmaféresis puede conllevar riesgos significativos, como la disminución de los niveles de calcio a valores peligrosos, debido al uso de citrato como anticoagulante, que se une al calcio en la sangre. Además, el procedimiento, que implica la extracción de entre 3 y 4 litros de sangre por sesión, puede provocar alteraciones temporales en la coagulación. Entre los efectos secundarios más frecuentes se encuentran: Hormigueo en los labios, mareos, aturdimiento, sudoración, sensación de frío, calambres, sangrado en la zona del catéter, prurito, sibilancias y erupciones cutáneas.(26)
En el caso del Intacglobin, la literatura describe la aparición poco frecuente del síndrome de meningitis aséptica, asociado a altas dosis, cuyos síntomas incluyen cefalea, rigidez de nuca, fiebre, fotofobia, náuseas, vómitos, leucocitosis y elevación de proteínas en el LCR. Otros efectos adversos son taquicardia, náuseas, opresión torácica, fiebre, escalofríos, cefalea y erupciones cutáneas. Además, debido a que es un fármaco derivado del plasma humano, existe un riesgo inherente, aunque reducido, de transmisión de enfermedades infecciosas, a pesar de las medidas de seguridad adoptadas.(27)
Jusvinza, por el contrario, ha mostrado un perfil de seguridad más favorable, con efectos secundarios generalmente leves o moderados. Los más reportados incluyen incremento del apetito, dolor y ardor en el sitio de inyección, cefalea, mareos, náuseas, prurito e infecciones cutáneas.(29)
Las principales limitaciones de este estudio exploratorio radican en el tamaño reducido de la muestra y la ausencia de un grupo control, sin tratamiento (solo fueron dos pacientes). Adicionalmente, no se realizaron mediciones de biomarcadores relacionados con el mecanismo de acción del péptido; aspecto que deberá abordarse en futuras investigaciones.
Jusvinza induce una mejoría rápida en los pacientes con el SGB, con buen perfil de seguridad, lo que representa un punto de partida para investigaciones futuras.
REFERENCIAS BIBLIOGRÁFICAS
1. Hughes RA, Cornblath DR. Guillain-Barré syndrome [Internet]. The Lancet. 2005; 366(9497): 1653-66. DOI: 10.1016/S0140-6736(05)67665-9
2. Shoenfeld Y, George J, Peter JB. Guillain-Barre as Autoimmune disease [Internet]. International Archives of Alergy and Immunology. 1996; 109: 318-326. DOI: 10.1159/000237258
3. Susuki K, Rasband MN, Tohyama K, Koibuchi K, Okamoto S, Funakoshi K, et al. Anti-GM1 Antibodies Cause Complement-Mediated Disruption of Sodium Channel Clusters in Peripheral Motor Nerve Fibers [Internet]. J Neurosci. 2007; 27(15): 3956 –67. DOI: 10.1523/JNEUROSCI.4401-06.2007
4. Nguyen TP, Taylor RS. Guillain-Barre Syndrome [Internet]. Treasure Island (FL): StatPearls Publishing; 2025. [acceso: 23/03/2025]. Disponible en: https://www.ncbi.nlm.nih.gov/books/NBK532254
5. Hartung HP, Toyka KV. T-cell and Macrophage Activation in Experimental Autoimmune Neuritis and Guillain-Barre Syndrome [Internet]. Annals of Neurology.1990; 27: S57-S63. DOI: 10.1002/ana.410270716
6. Koike H, Nishi R, Ikeda S, Kawagashira Y, Iijima M, Katsuno M, et al .Ultrastructural mechanisms of macrophage-induced demyelination in CIDP [Internet]. Neurology. 2018; 91: 1-10. DOI: 10.1212/WNL.0000000000006625
7. World Health Organization. Assessment and management of Guillain-Barré syndrome in the context of Zika virus infection [Internet]. WHO, Interim guidance update. 2016 [acceso: 10/03/2025]; 1(16.4): [aprox. 10 pant.]. Disponible en: https://www.who.int/publications/i/item/WHO-ZIKV-MOC-16.4-Rev.1
8. Dominguez MC, Lorenzo N, Barbera A, Darrasse-Jeze G, Hernández MV, Torres A, et al. An altered peptide ligand corresponding to a novel epitope from heat-shock protein 60 induces regulatory T cells and suppresses pathogenic response in an animal model of adjuvant-induced arthritis [Internet]. Autoimmunity. 2011; 44(6): 471-82. DOI: 10.3109/08916934.2010.550590
9. Venegas-Rodriguez R, Santana-Sanchez R,Peña-Ruiz R, Bequet-Romero M, Hernandez-Cedeño M, Santiesteban-Licea E, et al. CIGB-258 Immunomodulatory Peptide: Compassionate Use for Critical and Severe COVID-19 Patients [Internet]. Austin J Pharmacol Ther. 2020 [acceso: 22/03/2025]; 8(1):1119. Disponible en: https://austinpublishinggroup.com/pharmacology-therapeutics/fulltext/ajpt-v8-id1119.php
10. Baldomero JE, Del Río Martín A, Cruz LR,Venegas R, Hernández M, Serrano A,Peña R, et al. Early Treatment with a Peptide Derived from the Human Heat-Shock 60 Protein Avoids Progression to Severe Stages of COVID-19 [Internet]. J Biotechnol Biomed. 2021; 4(4): 196-210. DOI: 10.26502/jbb.2642-91280045
11. Venegas-Rodríguez R,Serrano-Díaz A, Peña-Ruiz R, Santana R, Hernández-Cedeño M, Rittoles Navarro A, et al. Jusvinza, an anti-inflammatory drug derived from the human heat-shock protein 60, for critically ill COVID-19 patients. An observational study[Internet]. PLoSONE. 2022;18 (2): e0281111. DOI: 10.1371/journal.pone.0281111
12. WMA. World Medical Association Declaration of HelsinkiEthical Principles for Medical Research Involving Human Participants. JAMA; 2025;333;(1):71-74. DOI: 10.1001/jama.2024.21972
13. Ministerio de Salud Pública. Regulación No. 45-2007: Requerimientos para la notificación y el reporte de eventos adversos graves e inesperados en los ensayos clínicos [Internet]. La Habana: CECMED; 2007. [acceso: 22/03/2025]. Disponible en: https://www.cecmed.cu/sites/default/files/adjuntos/Reglamentacion/reg_4507_requerimientos_para_la_notificacion_y_el_reporte_de_eventos_adversos_graves_e_inesperados_en_los_ensayos_clinicos.pdf
14. Quan S, Sheng JR,Abraham PM. Regulatory T and B lymphocytes in a spontaneous autoimmune polyneuropathy [Internet]. Clin Exp Immunol. 2016; 184:50-61. DOI: 10.1111/cei.12756
15. Domínguez MC, Lorenzo N, Barberá A, Padrón G, Torres AM ,Hernández MV, et al. Therapeutic effect of two altered peptide ligands derived from the human heat shock protein 60 in experimental models of rheumatoid arthritis [Internet]. Biotecnología Aplicada. 2013 [acceso: 23/03/2025]; 30(2):153-6. Disponible en: https://www.medigraphic.com/cgi-bin/new/resumenI.cgi?IDARTICULO=48194
16. Lorenzo N, Altruda F, Silengo L, Dominguez MC. APL-1, an altered peptide ligand derived from heat-shock protein, alone or combined with methotrexate attenuates murine collageninduced arthritis [Internet]. Clin Exp Med. 2017; 17(2):209-16. DOI: 10.1007/s10238-016-0412-7
17. Barberá A, Lorenzo N, Garrido G, Mazola Y, Falcón V, Torres AM, et al . APL-1, an altered peptide ligand derived from human heat-shock protein 60, selectively induces apoptosis in activated CD4+ CD25+ T cells from peripheral blood of rheumatoid arthritis patients [Internet]. Int Immunopharmacol. 2013; 17(4):1075-83. DOI: 10.1016/j.intimp.2013.10.010
18. Barberá A, Lorenzo N, van Kooten P, van Roon J, de Jager W, Prada D, et al. APL1, an altered peptide ligand derived from human heat-shock protein 60, increases the frequency of Tregs and its suppressive capacity against antigen responding effector CD4+Tcells from rheumatoid arthritis patients [Internet]. Cell Stress Chaperones. 2016; 21(4):735-44. DOI: 10.1007/s12192-016-0698-0
19. Hernández-Cedeño M, Rodríguez-Ulloa A, Ramos Y, González LJ, Serrano-Díaz A, Zettl K, Wiśniewski JR, et al. Proteomic Profile Regulated by the Immunomodulatory Jusvinza Drug in Neutrophils Isolated from Rheumatoid Arthritis Patients [Internet]. Biomedicin. 2024; 29(12):2740. DOI: 10.3390/biomedicines12122740
20. Hernandez-Cedeño M, Venegas-Rodriguez R, Peña-Ruiz R, Bequet-Romero M, Santana-Sanchez R, Penton-Arias E, et al. CIGB-258, a peptide derived from human heat-shock protein 60, decreases hyperinflammation in COVID-19 patients [Internet]. Cell Stress Chaperones. 2021; 26(3):515-25. DOI: 10.1007/s12192-021-01197-2
21. Venegas R, Serrano A, Peña R, Santana R, Rittoles A, Grecesqui I et al. El tratamiento con Jusvinza disminuye la hiperinflamación y la hipercoagulación en pacientes críticos con la COVID-19 [Internet]. Rev Cub Med Mil. 2021 [acceso: 22/03/2025]; 50(4): e02101675. Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0138-65572021000400018&lng=es
22. Ackermann G, Paw B. Zebrafish: a genetic model for vertebrate organogenesis and human disorders [Internet]. Front Biosci. 2003; 8: d1227-53. DOI: 10.2741/1092
23. Cho KH, Nam HS, Kim JE, Na HJ, Dominguez-Horta MC, Martinez-Donato G. CIGB-258 Exerts Potent AntiInflammatory Activity against CarboxymethyllysineInduced Acute Inflammation in Hyperlipidemic Zebrafish via the Protection of Apolipoprotein A-I [Internet]. Int J Mol Sci. 2023; 24:7044. DOI: 10.3390/ijms24087044
24. Cho KH, Bahuguna A, Lee Y, Lee SH, Dominguez-Horta MC, Martinez-Donato G. Synergistic Anti Inflammatory Activity of Lipid-Free Apolipoprotein (apo) A-I and CIGB-258 in Acute-Phase Zebrafish via Stabilization of the apoA-I Structure to Enhance Anti-Glycation and Antioxidant Activities [Internet]. Int J Mol Sci. 2024; 25(10): 5560. DOI: 10.3390/ijms25105560
25. Cho KH, Kim JE, Kang DJ, Dominguez-Horta MC, Martinez-Donato G. Synergistic Anti-Inflammatory Activity of Apolipoprotein A-I and CIGB-258 in Reconstituted High-Density Lipoproteins (rHDL) against Acute Toxicity of Carboxymethyllysine in Zebrafish and Its Embryo [Internet]. Pharmaceuticals. 2024; 17(2):165. DOI: 10.3390/ph17020165
26. IWMF: International Waldenstrom´s Macroglobulinemia Foundation. Ficha técnica de la Plasmaféresis [Internet]. IWMF; 2015. [acceso: 10/03/2025]. Disponible en: https://iwmf.com/wp-content/uploads/2020/10/Plasmapheresis-Fact-Sheet-Spanish.pdf
27. Centro para el Control Estatal de Medicamentos Equipos y Dispositivos Médicos. Resumen de las características del producto Intacglobin [Internet]. Cuba, La Habana: CECMED; 2013. [acceso: 20/03/2025]. Disponible en: https://www.cecmed.cu/sites/default/files/adjuntos/rcp/biologicos/rcp_intacglobin_5_2013-12-19.pdf
28. Domínguez-Horta MDC, Serrano-Díaz A, Hernández-Cedeño M, Martínez-Donato G, Guillén-Nieto G. A peptide derived from HSP60 reduces proinflammatory cytokines and soluble mediators: a therapeutic approach to inflammation [Internet]. Front Immunol. 2023; 28(14):1162739. DOI: 10.3389/fimmu.2023.1162739.89
29. Prada D , Gómez J, Lorenzo N, Corrales O, López A, González E, et al. Phase I Clinical Trial with a Novel Altered Peptide Ligand Derived from Human Heat-Shock Protein 60 for Treatment of Rheumatoid Arthritis: Safety, Pharmacokinetics and Preliminary Therapeutic Effects [Internet]. Journal of Clinical Trials. 2018; 8(1):1000339. DOI: 10.4172/2167-0870.1000339
Conflictos de interés
El fármaco Jusvinza se desarrolló por el Centro de Ingeniería Genética y Biotecnología de Cuba. Los autores afiliados a este centro participaron en el desarrollo del fármaco.
Contribuciones de los autores
Conceptualización: Rafael Venegas Rodríguez, María del Carmen Domínguez Horta.
Curación de datos: Rafael Venegas Rodríguez, Anabel Serrano Diaz, Mabel Hernández.
Análisis formal: María del Carmen Domínguez Horta, Anabel Serrano Díaz, Rafael Venegas Rodríguez.
Investigación: Raúl Santana Sánchez, Rafael Venegas Rodríguez, Rubén Peña, Raúl Santana.
Metodología: María del Carmen Domínguez Horta, Rafael Venegas Rodríguez, Anabel Serrano Diaz.
Administración del proyecto: Gillian Martínez Donato, Rafael Venegas Rodríguez.
Supervisión: María del Carmen Domínguez, Rafael Venegas.
Validación: María del Carmen Domínguez, Anabel Serrano, Rafael Venegas. Visualización: María del Carmen Domínguez, Anabel Serrano, Rafael Venegas.
Redacción – borrador original: María del Carmen Domínguez, Anabel Serrano, Mabel Hernández.
Redacción – revisión y edición: María del Carmen Domínguez, Anabel Serrano, Rafael Venegas.
Declaración de disponibilidad de datos
Los datos utilizados para el presente estudio se pueden obtener previa solicitud al autor Rafael Venegas Rodríguez, correo electrónico: rafavr@infomed.sld.cu