Artículo de Investigación
Desarrollo del índice de disfunción respiratoria para mortalidad temprana, en pacientes con insuficiencia renal aguda
Development of a respiratory dysfunction Index to predict early mortality in acute kidney injury patients
Alberto Guevara Tirado1* https://orcid.org/0000-0001-7536-7884
1Universidad Científica del Sur. Lima, Perú.
*Autor para la correspondencia. Correo electrónico: albertoguevara1986@gmail.com
Introducción:
La insuficiencia renal aguda puede provocar disfunción respiratoria, pero
no existe un índice específico para evaluarla de manera integral.
Objetivo: Desarrollar y evaluar el desempeño del índice de disfunción
respiratoria en insuficiencia renal aguda para predecir la mortalidad a corto
plazo.
Métodos:
Estudio de cohorte retrospectivo, con datos secundarios de 5060 pacientes
hospitalizados por insuficiencia renal aguda. Variables analizadas: Clínicas
y bioquímicas; frecuencia respiratoria, saturación de oxígeno, creatinina, anión
gap, bicarbonato, hemoglobina, presión arterial y parámetros hemodinámicos.
Se realizó análisis de componentes principales (ACP), se evaluó adecuación mediante
el índice de Kaiser-Meyer-Olkin (KMO) y la prueba de esfericidad de Bartlett.
Desde el ACP se construyó un índice de disfunción respiratoria en insuficiencia
renal aguda, que se evaluó mediante el área bajo la curva, regresión de Cox
para mortalidad a 14 días y el análisis de Kaplan-Meier.
Resultados:
El ACP mostró una adecuación moderada (KMO= 0,522; p< 0,001), e identificación
de 7 componentes. Se desarrolló el índice de disfunción respiratoria en insuficiencia
renal aguda, basado en la frecuencia respiratoria y saturación de oxígeno (área
bajo la curva = 0,735; IC95 %:0,710-0,760) para predecir mortalidad 14 días.
En el análisis de Kaplan-Meier, los pacientes con un índice elevado tuvieron
menor supervivencia (161,5 vs. 275,9 días; p< 0,001). En la regresión de
Cox, un índice elevado se asoció con mayor riesgo de mortalidad (HR= 2,323;
IC95 %:1,895-2,848; p< 0,001).
Conclusiones:
El índice de disfunción respiratoria en insuficiencia renal aguda es una
herramienta útil para predecir la mortalidad en estos pacientes.
Palabras clave: hipoxia; índice de severidad de la enfermedad; lesión renal aguda; mortalidad hospitalaria; síndrome de dificultad respiratoria.
Introduction:
Acute kidney injury can lead to respiratory dysfunction, yet no specific
index currently exists to assess it comprehensively.
Objective: To develop and evaluate the performance of the Respiratory
Dysfunction Index in Acute Kidney Injury for predicting short-term mortality.
Methods: A retrospective cohort study using secondary data from 5,060
hospitalized Acute Kidney Injury (AKI) patients. Clinical and biochemical variables
were analyzed, including respiratory rate, oxygen saturation, creatinine, anion
gap, bicarbonate, hemoglobin, blood pressure, and hemodynamic parameters. Principal
component analysis (PCA) was applied, with model adequacy assessed using the
Kaiser-Meyer-Olkin index and Bartlett's test of sphericity. Based on PCA, the
Respiratory Dysfunction Index in AKI was constructed and evaluated using the
area under the curve (AUC), Cox regression for 14-day mortality, and Kaplan-Meier
survival analysis.
Results: PCA showed moderate adequacy (Kaiser-Meyer-Olkin = 0.522; p<
0.001) and identified seven components. The Respiratory Dysfunction Index in
AKI was developed based on respiratory rate and oxygen saturation (AUC = 0.735;
95% CI: 0.710-0.760) to predict 14-day mortality. In Kaplan-Meier analysis,
patients with a high index had lower survival (161.5 vs. 275.9 days; p< 0.001).
In Cox regression, a high index was associated with increased mortality risk
(HR = 2.323; 95% CI: 1.895-2.848; p< 0.001).
Conclusions: The Respiratory Dysfunction Index in Acute Kidney Injury
proved to be a useful tool for predicting mortality in patients with AKI.
Keywords: acute kidney injury; hospital mortality; hypoxia; respiratory distress syndrome; severity of illness index.
Recibido: 12/05/2025
Aprobado:
10/06/2025
INTRODUCCIÓN
La insuficiencia renal aguda (IRA) es una afección crítica caracterizada por una disminución rápida de la función renal, asociada a un alto riesgo de complicaciones y mortalidad en pacientes hospitalizados.(1) Los riñones desempeñan un papel esencial en la homeostasis del volumen de líquidos, el equilibrio ácido-base y la regulación de electrolitos.(2) Su deterioro afecta a múltiples sistemas, incluido el respiratorio, lo que agrava la evolución clínica del paciente.
El deterioro respiratorio en la IRA puede estar influenciado por diversos mecanismos fisiopatológicos en el contexto de la enfermedad renal crónica. La sobrecarga de volumen debida a la incapacidad de eliminar el exceso de líquidos puede provocar edema pulmonar y disminución del intercambio gaseoso, lo que compromete la oxigenación.(3) La acidosis metabólica, consecuencia de la acumulación de ácidos no volátiles, estimula la hiperventilación compensatoria, lo que incrementa la carga respiratoria.(4) Además, las alteraciones electrolíticas, como la hiperkalemia y la hipocalcemia, pueden provocar disfunción neuromuscular,(5) lo que afecta a la contractilidad diafragmática y la mecánica ventilatoria.
En la actualidad, no existe un índice específico para evaluar la disfunción respiratoria a corto plazo en pacientes con IRA. Aunque se utilizan herramientas generales como la gasometría arterial, escalas de gravedad (SOFA, APACHE II), parámetros ventilatorios, imágenes pulmonares y biomarcadores, se necesita una herramienta integrada y específica que permita una mejor estratificación del riesgo en este contexto.
En este sentido, la creación de un índice de disfunción respiratoria podría ser una herramienta valiosa para estratificar el riesgo y mejorar la predicción de mortalidad en estos pacientes.
Por ello, el objetivo del presente estudio es desarrollar y evaluar el desempeño del índice de disfunción respiratoria en insuficiencia renal aguda (IDR-IRA) para predecir la mortalidad a corto plazo, lo que podría proporcionar un enfoque novedoso para evaluar el compromiso respiratorio en este contexto clínico.
MÉTODOS
Diseño
Estudio de cohorte retrospectivo, proveniente de una base de datos secundaria de un estudio titulado "Automated, medication-targeted alerts for Acute Kidney Injury - A randomized trial" (Alertas automatizadas y dirigidas a medicamentos para la lesión renal aguda: Un ensayo aleatorizado) cuyo objetivo fue evaluar el impacto de un sistema automatizado de apoyo a la toma de decisiones clínicas en la suspensión de medicamentos nefrotóxicos y en la evolución de los pacientes con insuficiencia renal aguda.(6) Dicho estudio se llevó a cabo en el año 2023.
Sujetos
La población del estudio incluyó a 5060 pacientes adultos hospitalizados con diagnóstico de IRA, definido según los criterios de Kidney Disease: Improving Global Outcomes (KDIGO) (incremento = 50 % en creatinina en 7 días o aumento de 0,3 mg/dL en 48 horas).(7) Para este análisis, se seleccionaron a todos los pacientes de la base de datos. Este estudio se llevó a cabo siguiendo las directrices de la guía RECORD (Reporting of Studies Conducted using Observational Routinely Collected Health Data).(8)
Variables
En este estudio se evaluaron variables clínicas, de laboratorio y hemodinámicas, de pacientes hospitalizados por insuficiencia renal aguda. Incluyó edad, días de hospitalización, función renal (tasa de filtración glomerular -TFG-, creatinina, nitrógeno ureico en sangre -BUN), equilibrio ácido-base y electrolitos (anión gap, bicarbonato, cloruro, sodio, potasio), parámetros hematológicos (hemoglobina, plaquetas, leucocitos) y signos vitales (presión arterial, pulso, frecuencia respiratoria, saturación de oxígeno y temperatura corporal).
Además, se consideraron variables categóricas como la mortalidad en los 14 días siguientes, la presencia de enfermedad renal crónica, insuficiencia cardíaca, enfermedad pulmonar, diabetes, hipertensión, cáncer y enfermedad hepática, así como los índices clínicos Elixhauser Score(9) y SOFA Score.(10)
Procedimientos
Se utilizó una base de datos secundaria de pacientes hospitalizados por IRA para construir el índice de disfunción respiratoria en insuficiencia renal aguda (IDR-IRA), mediante la aplicación de un análisis de componentes principales. Se evaluó la adecuación del modelo mediante el índice Kaiser-Meyer-Olkin (KMO) y la prueba de esfericidad de Bartlett; se seleccionaron los componentes con valores propios > 1.
El seguimiento de los pacientes se realizó hasta 14 días desde su hospitalización, se registró la ocurrencia de mortalidad como único evento clínico evaluado. Aquellos que no fallecieron durante el periodo de observación se consideraron censurados. La asociación del IDR-IRA con la mortalidad a los 14 días se analizó mediante curvas de Kaplan-Meier y modelos de regresión de Cox.
Procesamiento
Se emplearon estadísticos descriptivos para caracterizar a la población, lo que incluyó el análisis de las variables continuas como medias y desviación estándar, y las categóricas como frecuencias y porcentajes.
El IDR-IRA se construyó mediante un ACP, con rotación varimax, a través de la selección de las variables con mayor carga factorial. La capacidad predictiva del IDR-IRA frente a la mortalidad a 14 días se evaluó mediante el área bajo la curva (AUC). Además, se exploró la capacidad predictiva individual de otras variables clínicas y bioquímicas relevantes mediante AUC, a fin de comparar su desempeño frente al índice propuesto. La asociación entre el IDR-IRA y la mortalidad a 14 días se analizó mediante curvas de Kaplan-Meier, prueba de Log-Rank y regresión de Cox, así como el reporte de razones de riesgo con intervalos de confianza al 95 %. Todos los análisis se realizaron con el softwareIBM-SPSS Statistics 25™.
Aspectos bioéticos
La base de datos se alojó en Dryad bajo licencia Creative Commons (CC0), lo que permitió su uso sin restricciones. Los datos se anonimizaron y codificaron para garantizar la privacidad de los participantes, conforme con la Declaración de Helsinki. La información está disponible en: https://datadryad.org/stash/dataset/doi:10.5061/dryad.kh189327p#citations.
RESULTADOS
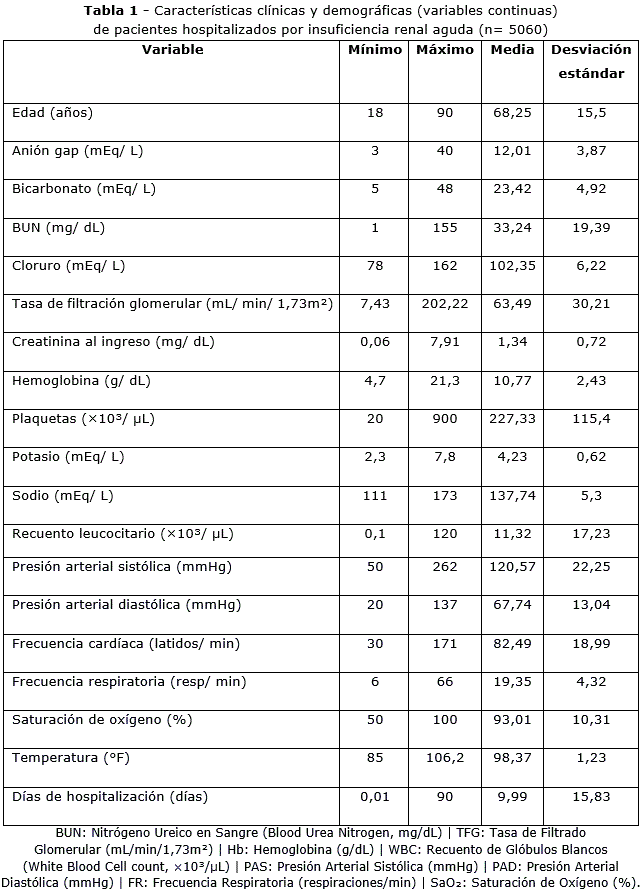
La cohorte de pacientes hospitalizados por insuficiencia renal aguda presentó una marcada heterogeneidad clínica y bioquímica. Se observaron grandes variaciones en la edad, función renal, equilibrio ácido-base y parámetros hematológicos. Las alteraciones en creatinina, BUN y TFG reflejaron diferentes grados de compromiso renal, mientras que los niveles de bicarbonato y anión gap evidenciaron desequilibrios metabólicos frecuentes. También se identificaron fluctuaciones en los electrolitos séricos, constantes vitales y parámetros como saturación de oxígeno y temperatura, lo que sugirió distintos niveles de gravedad clínica. La duración de la hospitalización también fue variable, lo que refuerza la diversidad del perfil clínico de esta población (tabla 1).
En esta cohorte, se observó una alta carga de comorbilidades, con predominio de las afecciones cardiovasculares y metabólicas, así como una proporción considerable de pacientes con enfermedades crónicas y condiciones oncológicas o hepáticas. La estratificación de los puntajes de Elixhauser mostró una distribución centrada en niveles intermedios de comorbilidad, mientras que la evaluación mediante el SOFA Score evidenció mayoritariamente disfunción orgánica leve, con una fracción menor de casos en categorías graves. Estos hallazgos reflejan la heterogeneidad clínica de los pacientes hospitalizados por insuficiencia renal aguda (tabla 2).
Aunque se identificaron 7 componentes principales, la selección de variables para elaborar el índice se basó en 2 criterios: Primero, que la variable presentara una carga factorial elevada (> 0,4) en uno de los componentes retenidos; y segundo, que tuviera relevancia clínica y fisiopatológica en el contexto de la disfunción hemodinámica en insuficiencia renal aguda. En este sentido, la frecuencia respiratoria (FR) y la saturación de oxígeno (SO2) fueron las variables que, además de presentar cargas factoriales significativas en el componente 2 (0,465 para FR y -0,432 para SO2), representaban manifestaciones clínicas de compromiso respiratorio y hemodinámico. Por ello, estas 2 variables se seleccionaron para la construcción del índice IDR-IRA, como se detalla en la sección siguiente (tabla 3).
El IDR-IRA se construyó a partir del ACP; se identificaron como variables integrantes la frecuencia respiratoria y la saturación de oxígeno, por ser las que presentaron mayor carga factorial (tabla 2). Estas fueron las únicas variables incluidas en la fórmula final del índice. A partir de los pesos factoriales obtenidos, se elaboró la fórmula del IDR-IRA, la cual generaba un rango de valores negativos (de -43,20 a 8,37). Para facilitar su interpretación clínica, todos los valores fueron ajustados con la suma de 43,20 con la finalidad de mantener la proporcionalidad original. Este ajuste permitió que el IDR-IRA sea más práctico, tanto para su aplicación clínica como para fines investigativos (tabla 4).
Se evaluó la capacidad predictiva individual de variables clínicas relevantes, mediante el AUC, con el fin de comparar su desempeño frente al IDR-IRA. Para el IDR-IRA, se estableció un punto de corte de 10,95 con el cual se obtuvo la mayor capacidad discriminativa en la predicción de mortalidad a los 14 días, en pacientes con IRA (AUC= 0,735; IC95 %: 0,710-0,760). Otras variables relevantes fueron el anión gap (AUC= 0,686) y la FR (AUC= 0,684). En contraste, la saturación de oxígeno (AUC= 0,355), la presión arterial sistólica (AUC= 0,379) y la diastólica (AUC= 0,360) mostraron baja capacidad predictiva. El pulso (AUC= 0,662) y la TFG (AUC= 0,446) presentaron valores intermedios (tabla 5).
En el análisis de Kaplan-Meier, los pacientes con IDR-IRA elevado, según el punto de corte establecido en la tabla 4 (IDR-IRA = 10,95), mostraron menor probabilidad de supervivencia a los 14 días. Aunque el período de seguimiento fue de 14 días, la supervivencia media se expresó en función del total de días observados, según la estimación del modelo de Kaplan-Meier. Los pacientes con IDR-IRA = 10,95 presentaron una menor supervivencia media y mayor riesgo de mortalidad a 14 días, en comparación con aquellos con valores inferiores. Esta diferencia fue significativa según la prueba de Log-Rank y la regresión de Cox, lo que posiciona al IDR-IRA como un predictor clave de mortalidad temprana en pacientes con insuficiencia renal aguda (tabla 5).
DISCUSIÓN
El estudio desarrolló y evaluó el IDR-IRA para predecir la mortalidad en los 14 días en pacientes con IRA. Se identificaron la FR y la saturación de oxígeno como los principales predictores mediante ACP. A pesar de la relevancia de otras variables, el IDR-IRA se basó en estos 2 parámetros por su valor clínico, mediante el ajuste de los valores a la suma de 43,20 para facilitar su interpretación sin alterar las relaciones de riesgo.
La FR elevada en pacientes con IRA puede deberse a varios mecanismos. La acidosis metabólica, común en estos pacientes debido a la reducción de la excreción renal de ácidos, estimula la hiperventilación para eliminar el CO2 y restablecer el equilibrio ácido-base.(11) Además, la sobrecarga de volumen, frecuente en la IRA, puede causar edema pulmonar, lo que afecta el intercambio gaseoso y provoca una respuesta respiratoria aumentada. La hipoxemia resultante estimula a los quimiorreceptores periféricos, que conduce a un incremento de la ventilación con el fin de mejorar la oxigenación tisular.(12) En consecuencia, la disfunción endotelial y la inflamación sistémica en la IRA pueden aumentar la permeabilidad vascular,(13) que favorece la extravasación de líquido hacia el intersticio pulmonar y exacerba la disfunción respiratoria.
El IDR-IRA mostró una capacidad predictiva elevada para la mortalidad a 14 días (AUC= 0,735), y superó a otras variables clínicas y bioquímicas. Este desempeño destaca la relevancia de la frecuencia respiratoria y la saturación de oxígeno en el pronóstico de pacientes con IRA. El anión gap también presentó una buena capacidad discriminativa (AUC= 0,686), lo cual reflejó acidosis metabólica no compensada, común en la IRA.(14) La frecuencia respiratoria (AUC= 0,684) se asocia con hipoxemia y compensación de la acidosis,(15) aunque su valor predictivo es inferior al del IDR-IRA al no integrar otras dimensiones funcionales.
El análisis de Kaplan-Meier mostró menor supervivencia en pacientes con IDR-IRA elevado (161,5 vs. 275,9 días). Esto sugiere mayor disfunción respiratoria asociada a hipoxia, acidosis metabólica y alteraciones hemodinámicas. La acumulación de toxinas urémicas y la inflamación sistémica pueden agravar la disfunción pulmonar.(16) El análisis de regresión de Cox confirmó al IDR-IRA como predictor independiente de mortalidad (Exp (B)= 2,323; IC95 %: 1,895 - 2,848; p< 0,001), al duplicar el riesgo de eventos adversos, lo cual podría atribuirse por la progresión de la insuficiencia respiratoria y su impacto sistémico.
El IDR-IRA ofrece una herramienta rápida y objetiva para evaluar la disfunción respiratoria en pacientes con insuficiencia renal aguda, cuya fisiopatología incluye edema pulmonar, acidosis metabólica y disfunción diafragmática.(17) Permite detectar la disfunción de forma temprana y el manejo oportuno, lo que mejora la estratificación del riesgo y los desenlaces hospitalarios. Se requieren estudios adicionales para validar su aplicabilidad y optimizar su precisión mediante nuevas variables o enfoques de modelado.
Una limitación del estudio es que el IDR-IRA se basa en una población hospitalaria específica, lo que requiere cautela al generalizarlo a otros entornos y pacientes. Además, aunque solo se incluyen 2 variables, es posible que no refleje de forma completa la complejidad de la insuficiencia respiratoria. Se necesitan estudios adicionales con cohortes más amplias para evaluar su solidez y validez externa.
En conclusión, el IDR-IRA es una herramienta útil para predecir la mortalidad en pacientes con IRA, ya que emplea parámetros respiratorios simples y de fácil medición. Su uso puede contribuir a la detección temprana de la disfunción respiratoria y a la optimización de la atención clínica de estos pacientes.
REFERENCIAS BIBLIOGRÁFICAS
1. Kellum JA, Romagnani P, Ashuntantang G, Ronco C, Zarbock A, Anders H-J. Acute kidney injury [Internet]. Nat Rev Dis Primers. 2021;7(1):52. DOI: http://dx.doi.org/10.1038/s41572-021-00284-z
2. Imenez Silva PH, Mohebbi N. Kidney metabolism and acid-base control: back to the basics [Internet]. Pflugers Arch. 2022;474(8):919-34. DOI: http://dx.doi.org/10.1007/s00424-022-02696-6
3. Gembillo G, Calimeri S, Tranchida V, Silipigni S, Vella D, Ferrara D, et al. Lung dysfunction and chronic kidney disease: A complex network of multiple interactions [Internet]. J Pers Med. 2023;13(2): [aprox. 10 pant.]. DOI: http://dx.doi.org/10.3390/jpm13020286
4. Adamczak M, Surma S. Metabolic acidosis in patients with CKD: Epidemiology, pathogenesis, and treatment [Internet]. Kidney Dis (Basel). 2021;7(6):452-67. DOI: http://dx.doi.org/10.1159/000516371
5. Di Lullo L, Reeves PB, Bellasi A, Ronco C. Cardiorenal syndrome in acute kidney injury [Internet]. Semin Nephrol. 2019;39(1):31-40. DOI: http://dx.doi.org/10.1016/j.semnephrol.2018.10.003
6. Wilson FP, Yamamoto Y, Martin M, Coronel-Moreno C, Li F, Cheng C, et al. A randomized clinical trial assessing the effect of automated medication-targeted alerts on acute kidney injury outcomes [Internet]. Nat Commun. 2023;14(1):2826. DOI: http://dx.doi.org/10.1038/s41467-023-38532-3
7. Bollenbecker S, Czaya B, Gutiérrez OM, Krick S. Lung-kidney interactions and their role in chronic kidney disease-associated pulmonary diseases [Internet]. Am J Physiol Lung Cell Mol Physiol. 2022;322(5):L625-40. DOI: http://dx.doi.org/10.1152/ajplung.00152.2021
8. RECORD Steering Committee. The REporting of studies Conducted using Observational Routinely-collected health Data (RECORD) Statement [Internet]. Equator-network.org; 2015 [acceso: 29/05/2024]. Disponible en: https://www.equator-network.org/reporting-guidelines/record/
9. Moreno R, Rhodes A, Piquilloud L, Hernandez G, Takala J, Gershengorn HB, et al. The Sequential Organ Failure Assessment (SOFA) Score: has the time come for an update? [Internet]. Crit Care. 2023;27(1):15. DOI: http://dx.doi.org/10.1186/s13054-022-04290-9
10. Mehta HB, Li S, An H, Goodwin JS, Alexander GC, Segal JB. Development and validation of the summary Elixhauser comorbidity score for use with ICD-10-CM-coded data among older adults [Internet]. Ann Intern Med. 2022;175(10):1423-30. DOI: http://dx.doi.org/10.7326/M21-4204
11. Kim HJ. Metabolic acidosis in chronic kidney disease: Pathogenesis, clinical consequences, and treatment [Internet]. Electrolyte Blood Press. 2021;19(2):29-37. DOI: http://dx.doi.org/10.5049/EBP.2021.19.2.29
12. Prabhakar NR, Peng Y-J. Peripheral chemoreceptors in health and disease [Internet]. J Appl Physiol. 2004;96(1):359-66. DOI: http://dx.doi.org/10.1152/japplphysiol.00809.2003
13. Hatton GE, Isbell KD, Henriksen HH, Stensballe J, Brummerstedt M, Johansson PI, et al. Endothelial dysfunction is associated with increased incidence, worsened severity, and prolonged duration of acute kidney injury after severe trauma [Internet]. Shock. 2021;55(3):311-5. DOI: http://dx.doi.org/10.1097/SHK.0000000000001638
14. Zhu A, Whitlock RH, Ferguson TW, Nour-Mohammadi M, Komenda P, Rigatto C, et al. Metabolic acidosis is associated with acute kidney injury in patients with CKD [Internet]. Kidney Int Rep. 2022;7(10):2219-29. Disponible en: http://dx.doi.org/10.1016/j.ekir.2022.07.005
15. Pippalapalli J, Lumb AB. The respiratory system and acid-base disorders [Internet]. BJA Educ. 2023;23(6):221-8. DOI: http://dx.doi.org/10.1016/j.bjae.2023.03.002
16. Lee SA, Cozzi M, Bush EL, Rabb H. Distant organ dysfunction in acute kidney injury: A review [Internet]. Am J Kidney Dis. 2018;72(6):846-56. DOI: http://dx.doi.org/10.1053/j.ajkd.2018.03.028
17. Park BD, Faubel S. Acute kidney injury and acute respiratory distress syndrome [Internet]. Crit Care Clin. 2021;37(4):835-49. DOI: http://dx.doi.org/10.1016/j.ccc.2021.05.007
Conflictos de interés
El autor declara que no existen conflictos de interés.
Contribuciones de los autores
Autor único.
Declaración de disponibilidad de datos
Los datos se encuentran disponibles con la denominación "Automated, medication-targeted alerts for Acute Kidney Injury - A randomized trial", con DOI: https://datadryad.org/dataset/doi:10.5061/dryad.kh189327p. Los datos están disponibles según los términos de licencia Creative Commons CC0 1.0.