Artículo de Investigación
Estudio in vitro de la actividad antibacteriana de extractos etanólicos de Punica granatum y Syzygium aromaticum
In vitro study of the antibacterial activity of ethanolic extracts of Punica granatum and Syzygium aromaticum
Cinthya Yanina Santa Cruz López1* https://orcid.org/0000-0002-7352-058X
José Ernesto Romero-Flores2 https://orcid.org/0000-0003-3965-7491
Elizabeth Sarai Villegas-Manay2 https://orcid.org/0009-0005-0162-9139
Mario Moreno-Mantilla2 https://orcid.org/0000-0003-2559-0759
Fransk Carrasco-Solano2 https://orcid.org/0000-0002-9526-7116
1Universidad Nacional de Jaén. Instituto de Investigación en Ciencias de la Salud. Cajamarca, Perú.
2Universidad Nacional Pedro Ruiz Gallo. Facultad de Ciencias Biológicas. Lambayeque, Perú.
*Autor para la correspondencia. Correo electrónico: cisantacruzl@gmail.com
RESUMEN
Introducción: La resistencia de bacterias patógenas a los antibióticos es un fenómeno creciente, tanto en ambientes hospitalarios como comunitarios, lo que dificulta el tratamiento médico y la recuperación clínica de los pacientes. Una alternativa al problema se halla en las especies vegetales que poseen propiedades biológicas para combatir infecciones microbianas.
Objetivo: Determinar la actividad antibacteriana in vitro de los extractos etanólicos de Punica granatum L. y Syzygium aromaticum L.
Métodos: Investigación experimental que empleó extractos etanólicos de la granada y el clavo de olor, a las concentraciones de 100, 200, 300, 400 y 500 mg/mL, enfrentados a cepas de Staphylococcus aureus, Pseudomonas aeruginosa y Vibrio cholerae; se aplicaron tres repeticiones por cada ensayo. La susceptibilidad in vitro se determinó mediante las técnicas de disco difusión de Kirby-Bauer y macrodilución en caldo Müller Hinton.
Resultados: Todas las cepas bacterianas fueron sensibles a los extractos de la granada y el clavo de olor; se observó mayor actividad antibacteriana frente a Staphylococcus aureus. Con la concentración de 500 mg/mL se obtuvieron halos inhibitorios de hasta 20,5 y 20,0 mm de diámetro, respectivamente. Se estableció una concentración de mínima inhibitoria de 50 mg/mL para Staphylococcus aureus y de 100 mg/mL para las otras bacterias evaluadas.
Conclusión: Los extractos etanólicos elaborados a partir de la cáscara de Punica granatum L. y flores de Syzygium aromaticum L., poseen actividad antibacteriana relacionada con la dosis aplicada (mayor de 500 mg/mL), frente a Staphylococcus aureus, Pseudomonas aeruginosa y Vibrio cholerae.
Palabras clave: antibacteriano; bacterias gramnegativas; bacterias grampositivas; clavo de olor; extractos vegetales; granada.
ABSTRACT
Introduction: Antibiotic resistance in pathogenic bacteria is a growing phenomenon in both hospital and community settings, hindering medical treatment and clinical recovery of patients. An alternative to this problem lies in plant species that possess biological properties to combat microbial infections.
Objective: To determine the in vitro antibacterial activity of ethanolic extracts of Punica granatum L. and Syzygium aromaticum L.
Methods: An experimental investigation was conducted using ethanolic extracts of pomegranate and clove at concentrations of 100, 200, 300, 400, and 500 mg/mL, tested against strains of Staphylococcus aureus, Pseudomonas aeruginosa, and Vibrio cholerae; three replicates were performed for each assay. In vitro susceptibility was determined using the Kirby-Bauer disk diffusion and Müller-Hinton broth macrodilution techniques.
Results: All bacterial strains were sensitive to the pomegranate and clove extracts; the greatest antibacterial activity was observed against Staphylococcus aureus. At a concentration of 500 mg/mL, inhibitory zones of up to 20.5 and 20.0 mm in diameter were obtained. A minimum inhibitory concentration of 50 mg/mL was established for Staphylococcus aureus and 100 mg/mL for the other tested bacteria.
Conclusion: Ethanolic extracts made from Punica granatum L. peel and Syzygium aromaticum L. flowers have antibacterial activity related to the dose applied (greater than 500 mg/mL) against Staphylococcus aureus, Pseudomonas aeruginosa, and Vibrio cholerae.
Keywords: antibacterial; clove; gram-negative bacteria; gram-positive bacteria; plant extracts; pomegranate.
Recibido: 08/08/2025
Aprobado: 03/12/2025
INTRODUCCIÓN
La resistencia antimicrobiana de bacterias patógenas es un fenómeno progresivo a lo largo del tiempo; se observa tanto en ambientes hospitalarios como comunitarios. Se estima que, para el año 2050 generará alrededor de 10 millones de muertes en todo el mundo. Las prácticas inadecuadas del hombre, como el uso irracional de antibióticos y la automedicación han contribuido significativamente a incrementar esta problemática.(1,2)
La Organización Mundial de la Salud (OMS)(3) refiere que la resistencia antimicrobiana constituye una amenaza inminente para la salud humana y el desarrollo sostenible. Ante ello, en el año 2024, publicó un listado de microorganismos farmacorresistentes con prioridad media, alta y crítica, para elaborar nuevos fármacos. Esta situación se genera por la ineficacia de los tratamientos actuales para combatir las infecciones microbianas. Entre los patógenos con alta capacidad de desarrollar mecanismos de resistencia a los antibióticos se encuentran Staphylococcus aureus, Pseudomonas aeruginosa y Vibrio cholerae.
Esta problemática conlleva al incremento de la morbilidad y mortalidad humana,(4) al generar un importante impacto sobre la salud, y un enorme costo monetario, para tratar las enfermedades infecciosas producidas por diferentes patógenos.(5,6) Las pérdidas económicas generadas se relacionan con estancias hospitalarias más prolongadas, tratamientos más costosos y horas laborales incumplidas.(4,6)
Diversas investigaciones se enfocan en obtener nuevas alternativas terapéuticas frente a los microorganismos farmacorresistentes.(7,8) Ante ello, ha crecido el interés en los productos naturales, lo que lleva al análisis de compuestos activos que podrían facilitar la elaboración de fitofármacos con propiedades para combatir enfermedades infecciosas.(10,11) El potencial antibacteriano de los metabolitos secundarios de las plantas provienen de sus diversas estructuras químicas y mecanismos de acción. De modo que, estos compuestos bioactivos se investigan como alternativas naturales a los fármacos convencionales, con la finalidad de abordar la resistencia a los antibióticos y promover soluciones sostenibles a través del tiempo.(12)
Existe una gran variedad de especies vegetales empleadas por la medicina popular y tradicional, principalmente en poblaciones con bajos ingresos económicos y limitado acceso a la atención médica básica. Al respecto, Saavedra-Camacho J. y otros(9) evidenciaron la actividad antibacteriana del Beautempsia avicenniifolia (vichayo) frente a tres cepas hospitalarias de S. aureus. El efecto fue directamente proporcional a la concentración del extracto alcohólico. Otro estudio, realizado en Perú demostró que los extractos etanólicos de Caesalpinia spinosa (tara) inhiben el crecimiento de Escherichia coli BLEE, P. aeruginosa y S. aureus. El efecto fue mayor a la concentración de 500 mg/mL.(7)
Especies como la Punica granatum L., conocida como granada, ha evidenciado su potencial para tratar la diarrea, cáncer, hemorroides e infecciones cutáneas.(13) Este árbol de la familia Lythraceae presenta gran cantidad de compuestos fenólicos con propiedades beneficiosas para la salud, capaces de unirse a proteínas o glicoproteínas para hacer frente a bacterias farmacorresistentes.(14) Un estudio realizado en Brasil determinó la actividad bactericida in vitro de los extractos crudos de la granada frente a bacterias orales como Fusobacterium nucleatum, Porphyromonas gingivalis, Prevotella intermedia y Parvimonas micra.(15)
Así también, el Syzygium aromaticum L., conocido comúnmente como clavo de olor, presenta hojas, flores y yemas que tradicionalmente se utilizan para tratar heridas, quemaduras, vómitos, trastornos hepáticos, intestinales e infecciones dentales.(15) A este árbol, de la familia Myrtaceae se le atribuyen propiedades antimicrobianas, antiinflamatorias, antioxidantes y anticancerígenas.(16)
Por lo que, esta investigación brindó sustento científico de las propiedades de dos especies vegetales de consumo frecuente, para combatir enfermedades infecciosas ocasionadas por bacterias susceptibles a desarrollar farmacorresistencia. El objetivo del estudio es determinar la actividad antibacteriana in vitro de los extractos etanólicos de Punica granatum L. y Syzygium aromaticum L.
MÉTODOS
Estudio experimental desarrollado entre enero y diciembre del año 2020, en las instalaciones de Universidad Nacional Pedro Ruiz Gallo (UNPRG). La unidad de análisis estuvo conformada por 45 placas Petri sembradas con S. aureus, P. aeruginosa y Vibrio cholerae. Se utilizaron tres cepas de cada especie bacteriana, con cinco concentraciones de la cáscara de P. granatum L. (granada) y flores de S. aromaticum L. (clavo de olor).
Se consignaron como variables dependientes, la actividad antibacteriana frente a las cepas de S. aureus, P. aeruginosa y V. cholerae, expresada por el diámetro de los halos inhibitorios medidos en milímetros. Como variables independientes se consideró a los extractos etanólicos con concentraciones entre 100 y 500 mg/mL.
Las granadas y el clavo de olor empleados en este estudio se adquirieron en un mercado local de la ciudad de Lambayeque (Perú). La identificación y certificación de los especímenes vegetales se realizó en el Herbario Pedro Ruiz Gallo.
Preparación de los extractos vegetales
Antes de iniciar el proceso, se retiró la cáscara de la granada y se realizó su desinfección con torundas de algodón embebidas en alcohol al 70 %. Se lavó con agua destilada estéril y se deshidrató la cáscara en horno a 40 0C durante 72 horas. Posteriormente, se trituró el material vegetal y se colocó en un beaker, se agregó etanol al 96 % como solvente (1:10 m/v).(17)
El macerado del material vegetal deshidratado (cáscara), se realizó durante siete días a temperatura ambiental; se aplicó agitación diaria, a 50 rpm. Enseguida se filtró el producto por triplicado, utilizando papel de filtro Whatman N01. El solvente se concentró en un rotavapor (marca BOUCHI modelo R215) a 50 ºC durante 2 h. Posteriormente, se agregó etanol al 40 % (1:2 m/v) para obtener una solución madre de 500 mg/mL. Con esta solución se prepararon concentraciones de 100, 200, 300, 400 y 500 mg/mL, que fueron preservadas en refrigeración a 5 ºC hasta su utilización. Se realizó un procedimiento similar para preparar el otro extracto etanólico.(7)
Actividad antibacteriana de los extractos
Con la técnica de macrodilución en caldo Müller Hinton se determinó la concentración mínima inhibitoria (CMI).(15) El valor de la CMI se estableció al observarse ausencia de turbidez en los tubos inoculados (volumen final de 1 mL) con diferentes concentraciones de los extractos y las bacterias evaluadas, respecto a los controles positivo y negativo. Para verificar la actividad bactericida de los extractos, se sembró en agar tripticasa soya, el contenido de los tubos en los cuales previamente no se visualizó crecimiento bacteriano. Luego, se incubó a 35 °C ± 2 °C por 24 h ± 2 h, para finalmente realizar el recuento de colonias presentes en cada placa sembrada. El inóculo bacteriano se estandarizó espectrofotométricamente (absorbancia: 0,9, longitud de onda: 625 nm); se obtuvo una concentración inicial de 1,5 x 108 UFC/mL.
La actividad antibacteriana de los extractos, se determinó con la técnica de Kirby - Bauer.(16) A partir del inóculo previamente estandarizado y con ayuda de un hisopo estéril se realizó la siembra en la superficie de las placas servidas con agar Müller Hinton. Los discos estériles fueron embebidos con los extractos etanólicos a 100, 200, 300, 400, 500 mg/mL (por separado) y dimetilsulfóxido – DMSO 5 % (control negativo). Se dejaron secar los discos antes ser colocados sobre las placas sembradas. Las placas se dejaron reposar por 30 min a temperatura ambiente y fueron incubadas a 35 °C ± 2°C. Trascurridas 24 horas se midió el diámetro de los halos de inhibición (mm) y se registraron las medidas respecto a cada cepa evaluada.
La distribución de los datos y el supuesto de homogeneidad de las varianzas se comprobó con las pruebas de Shapiro Wilk y Levene, respectivamente. Se utilizó el análisis de varianza de un factor (ANOVA) con la finalidad de comparar la inhibición bacteriana obtenida, considerando la concentración del extracto y cepas microbianas. Asimismo, se empleó el test de Tukey para establecer la susceptibilidad de las especies bacterianas a los extractos a diferentes dosis. El análisis estadístico se realizó mediante el Software Minitab® 18 y el procesamiento preliminar de los datos en Microsoft Excel® 2018.
RESULTADOS
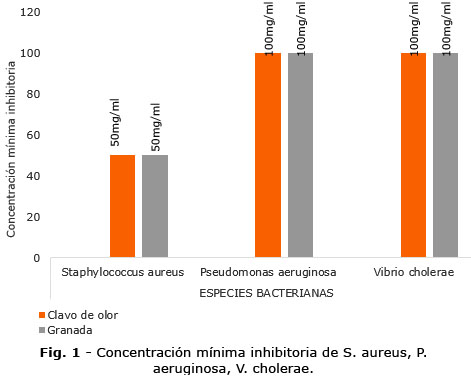
En la figura 1 se observan los valores obtenidos para las concentraciones mínimas inhibitorias de las cepas bacterianas evaluadas. Se denota que el S. aureus fue la especie más sensible a los extractos, ya que requirió menor concentración para inhibir su crecimiento en comparación de las otras bacterias analizadas.
En la tabla 1 se visualiza el diámetro de los halos de inhibición obtenidos al exponer las cepas bacterianas al extracto a distintas dosis. Al enfrentar las cepas de S. aureus, P. aeruginosa y V. cholerae al extracto a 500 mg/mL se obtuvieron halos inhibitorios de 20,5 mm, 17,0 mm y 16,3 mm, respectivamente.
Al emplear el extracto de S. aromaticum L., se observó que los diámetros de los halos inhibitorios evidencian una tendencia creciente de acuerdo con la dosis empleada. La concentración de 500 mg/mL ocasionó mayor inhibición del crecimiento de S. aureus, P. aeruginosa y V. cholerae. Se observaron halos inhibitorios de 20,0 mm, 14,6 mm y 17,2 mm, respectivamente (tabla 2).
El ANOVA demostró significación estadística entre la inhibición de las cepas bacterianas y las dosis de los extractos analizados. Además, se encontró significación por la especie bacteriana y en la interacción extracto-especie (p< 0,05). No fue así al evaluar únicamente el factor extracto (tabla 3).
Al aplicar la prueba de Tukey se demostró que los diámetros promedios de las zonas inhibitorias mantuvieron relación directa con el aumento de las concentraciones de los extractos empleados (tabla 4).
DISCUSIÓN
La resistencia antimicrobiana se ha incrementado considerablemente durante los últimos años, debido al uso excesivo de antibióticos y su eliminación inadecuada en el medio ambiente. La búsqueda de agentes farmacológicos novedosos, con mayor eficiencia, seguridad y al alcance de los pacientes, es una de las prioridades actuales en investigación. Ante ello, las especies vegetales ofrecen fuentes atractivas de compuestos bioactivos, que permitirían la obtención natural de antimicrobianos para tratar patógenos infecciosos.(9) Entre las especies vegetales con potencial antimicrobiano se encuentran la P. granatum L.(17) y S. aromaticum L.(18)
Las CMI para las cepas V. cholerae y P. aeruginosa fueron de100 mg/mL y para las cepas de S. aureus, de 50 mg/mL. De modo que, S. aureus presentó mayor susceptibilidad a los extractos, respecto a las otras especies bacterianas. Esto se debería a que el S. aureus por ser una bacteria grampositiva posee una estructura que facilita el acceso de los principios activos la membrana plasmática (sitio blanco). Por el contrario, en las bacterias gramnegativas, la membrana externa y las modificaciones conformacionales de las porinas limitan el paso de estas moléculas.(19,20)
En la acción de cinco concentraciones del extracto de cáscara de la granada frente a S. aureus, P. aeruginosa y V. cholerae se observó inhibición del crecimiento bacteriano. Scaglione E. y otros(21) también demostraron la eficacia antimicrobiana del extracto de cáscara de la granada; reportan halos de inhibición que oscilaron entre 9 y 16 mm al exponer a S. aureus meticilino resistente, P. aeruginosa y A. baumannii multidrogorresistente. En ese sentido, Kupnik K. y otros(20) determinaron la actividad antibacteriana de los extractos acuosos y etanólicos de la cáscara de granada; reportaron la inhibición del crecimiento de E. coli, P. aeruginosa, P. Fluorescens, Bacillus cereus, S. aureus y Streptococcus pyogenes. También demostraron mayor inhibición de las bacterias grampositivas (12 - 23mm) en comparación con gramnegativas (12 - 20 mm). Además, el estudio dilucidó que el uso de solventes, como etanol, permitió extraer concentraciones más altas de proantocianidinas, punicalagina o taninos condensados (compuestos fenólicos), respecto al agua. Esto coincide con los resultados de la presente investigación. Resalta la importancia del uso de solventes como el etanol, para recuperar los compuestos bioactivos presentes en el material vegetal.
Un estudio realizado en Pakistán(7) demostró que los polifenoles del extracto de cáscara de granada pueden limitar el crecimiento microbiano, eliminar radicales libres y minimizar el riesgo de cáncer y enfermedades cardiovasculares. Otras investigaciones recientes(21,22) sugieren que los polifenoles afectan la síntesis normal de ácidos nucleicos y la actividad de las enzimas, lo que ocasiona cambios en la expresión proteica y conformación lipídica de la membrana bacteriana, provocan lisis celular mediante la precipitación de proteínas en la membrana plasmática.(8) Sumado a ello, estarían relacionados con la interferencia directa o indirecta de la señalización intercelular bacteriana (quórum sensing), mecanismo empleado por las bacterias patógenas para evadir la respuesta inmunitaria del hospedero. Los compuestos fenólicos también se asocian a la defensa contra el efecto nocivo de los radicales libres y contribuyen a reducir el estrés oxidativo en la célula bacteriana.(23)
Respecto al extracto etanólico de S. aromaticum se evidenció inhibición del crecimiento de las tres especies bacterianas evaluadas. Los halos inhibitorios promedios presentaron un diámetro de hasta 20,0 mm con la concentración de 500 mg/mL (tabla 2). Resultados similares se reportan por Faujdar S. y otros(19) al evaluar la actividad del S. aromaticum L. frente a uropatógenos gramnegativos; se incluyen cepas productoras de BLEE y metalobetalactamasa (MBL). El clavo de olor no favoreció el crecimiento in vitro de los uropatógenos y fue de mayor eficacia contra las especies del género Proteus (19 mm) y E. coli (17 mm).
En la revisión sistemática desarrollada por Maggini V. y otros(24) se evidenció el potencial antimicrobiano del clavo de olor frente a patógenos que afectan la salud humana, entre ellos Salmonella typhimurium, E. coli, Klebsiella pneumoniae y P. aeruginosa. Entre los componentes antibacterianos contenidos en el clavo de olor resaltan el eugenol; se ha demostrado que este compuesto tiene la capacidad de destruir la membrana plasmática bacteriana y de ocasionar inflamación celular.(25,26) Además, puede ejercer actividad antioxidante significativa, por la presencia de un grupo alilo en su estructura química, que inhibe la peroxidación lipídica y limita la formación de especies reactivas de oxígeno.(26,27)
El análisis estadístico demostró la significación entre la inhibición de las cepas bacterianas y las dosis empleadas. Adicionalmente, encontró significancia por especie bacteriana y en la interacción extracto*especie, lo cual confirma el potencial antibacteriano de los extractos. Sin embargo, la actividad antibacteriana de especies vegetales puede variar y ser afectada por las características del microorganismo, temperatura, pH, concentración de sustancias antimicrobianas o la presencia de materia orgánica.(24) Se señala que las granadas y el clavo de olor, al ser adquiridos en un mercado local, el contenido de componentes bioactivos y sus propiedades también podría variar, debido a las condiciones climáticas y de los cultivos, prácticas agrícolas y las condiciones de almacenamiento y transporte.(28,29)
Como limitaciones del estudio se menciona que, solo se emplearon tres cepas o cultivos puros de cada especie bacteriana, lo que afecta el alcance de los resultados, ya que influye en su generalización y sugiere necesidad de estudios con mayor número de aislamientos bacterianos y repeticiones de los ensayos. Sin embargo, los resultados pueden fomentar la investigación de estas especies vegetales de consumo frecuente y la caracterización de sus moléculas biológicamente activas y sus propiedades antimicrobianas.
Los extractos de granada y clavo de olor pueden presentarse como una alternativa para combatir la resistencia antimicrobiana que genera cada vez más complicaciones de las infecciones en los hospitales y la comunidad. Asimismo, representan posibles soluciones, que, de manera integrada, pueden promover tanto la salud humana como animal.
Los extractos etanólicos elaborados a partir de la cáscara de Punica granatum L. y flores de Syzygium aromaticum L., poseen actividad antibacteriana relacionada con la dosis de los extractos (mayor de 500 mg/mL), frente a Staphylococcus aureus, Pseudomonas aeruginosa y Vibrio cholerae.
REFERENCIAS BIBLIOGRAFICAS
1. Camacho LA. Resistencia bacteriana, una crisis actual [Internet]. Rev Esp Salud Publica. 2023 [acceso: 08/06/2025]; 97: 1-10. Disponible en: https://pmc.ncbi.nlm.nih.gov/articles/PMC10541255/
2. Barrantes Jiménez K, Chacón Jiménez L, Arias AM. El impacto de la resistencia a los antibióticos en el desarrollo sostenible [Internet]. PSM. 2022 [acceso: 08/06/2025]; 19(2): 305-29. DOI: http://dx.doi.org/10.15517/psm.v0i19.47590
3. Organización Panamericana de la Salud. Patógenos multirresistentes que son prioritarios para la OMS - OPS/OMS [Internet]. OPS/OMS; 2021. [acceso: 08/06/2025]. Disponible en: https://www.paho.org/es/noticias/4-3-2021-patogenos-multirresistentes-que-son-prioritarios-para-om
4. Giono-Cerezo S, Santos-Preciado JI, Rayo Morfín-Otero Mdel, Torres-López FJ, Alcántar-Curiel MD. Resistencia antimicrobiana. Importancia y esfuerzos por contenerla [Internet]. Gac. Méd. Méx 2020;156(2): 172-80. DOI: https://doi.org/10.24875/gmm.20005624
5. Barros Gabriel MR, Melo E, Oliveira MI, Germinio JE, Santos Rosiel J, Oliveira Sibele R. Impacto financiero de la terapia con antibióticos en la resistencia a múltiples fármacos bacterianos en un hospital de emergencia en Pernambuco, Brasil [Internet]. Ars Pharm. 2020; 61(2): 121-6. DOI: https://dx.doi.org/10.30827/ars.v61i2.115337
6. Coopoosamy R, Singh K, Naidoo K, Nadasan DS. The role of phytomedicine: Bridging the gap between the past, present, and future [Internet]. Journal of Medicinal Plants for Economic Development. 2023; 7(1): 197. DOI: https://doi.org/10.4102/jomped.v7i1.197
7. Santa Cruz - López CY, Chapoñan M, Limo JA, Moreno MC. Susceptibilidad in vitro de bacterias patógenas a los extractos de Rosmarinus officinalis y Caesalpinia spinosa [Internet]. Rev Cubana Med Milit. 2023 [acceso: 12/06/2025];52(3): e02302933. Disponible en: https://revmedmilitar.sld.cu/index.php/mil/article/view/2933
8. Sarmiento Zurita AJ. Revisión: alternativas terapéuticas a los fármacos antimicrobianos por la problemática de multidrogoresistencia actual [Internet]. Rev Cient Cienc Méd. 2023 [acceso: 15/06/2025]; 26(2): 78-83. Disponible en: http://www.scielo.org.bo/scielo.php?pid=S1817-74332023000200078&script=sci_arttext
9. Pérez Aguedo D, Fornaris Pérez YA, Pérez AD. La medicina natural y tradicional como complemento de la terapia antimicrobiana [Internet]. Rev Cuban Med Mil. 2024 [acceso: 12/06/2025]; 53(2): e024025492. Disponible en: http://scielo.sld.cu/scielo.php?pid=S0138-65572024000200039&script=sci_arttext&tlng=pt
10. Mahmood MS, Ashraf A, Ali S, Siddique AB, Asad F, Abbas RZ, et al. Portrayal of Punica granatum L. peel extract through High Performance Liquid Chromatography and antimicrobial activity evaluation [Internet]. Braz J Biol. 2021 [acceso: 12/06/2025]; 83: e244435. Disponible en: http://www.scielo.br/j/bjb/a/TzBBtWkhvRZkK57JnpNRDbm/?lang=en
11. Bustamante A, García-Díaz D, Jiménez P, Valenzuela Rodrigo PME, Echeverría F. Potencial efecto terapéutico de los polifenoles obtenidos de la cáscara de granada en la esteatosis hepática [Internet]. Rev. chil. nutr. 2022; 49(1): 89-99. DOI: http://dx.doi.org/10.4067/S0717-75182022000100089
12. Batiha GES, Alkazmi LM, Wasef LG, Beshbishy AM, Nadwa EH, Rashwan EK. Syzygium aromaticum L. (Myrtaceae): Traditional Uses, Bioactive Chemical Constituents, Pharmacological and Toxicological Activities. Biomolecules [Internet]. 2020 [acceso: 12/06/2025];10(2): E202. Disponible en: https://pubmed.ncbi.nlm.nih.gov/32019140/
13. Haro-González JN, Castillo-Herrera GA, Martínez-Velázquez M, Espinosa-Andrews H. Clove essential oil (Syzygium aromaticum L. Myrtaceae): extraction, chemical composition, food applications, and essential bioactivity for human health [Internet]. Molecules. 2021 [acceso: 15/06/2025]; 26(21):6387. Disponible en: https://www.mdpi.com/1420-3049/26/21/6387
14. Ulanowska M, Olas B. Propiedades biológicas y perspectivas de aplicación del eugenol: una revisión [Internet]. Revista Internacional de Ciencias Moleculares. 2021; 22(7): 3671. DOI: https://doi.org/10.3390/ijms22073671
15. Kowalska-Krochmal B, Dudek-Wicher R. The minimum inhibitory concentration of antibiotics: methods, interpretation, clinical relevance [Internet]. Pathogens. 2021; 10(2):165. DOI: https://doi.org/10.3390/pathogens10020165
16. Sacsaquispe R. Manual de procedimientos para la prueba de sensibilidad antimicrobiana por el método de Disco Difusión [Internet]. Perú: Instituto Nacional de Salud; 2002. [acceso: 15/06/2025]. Disponible en: https://cdn.www.gob.pe/uploads/document/file/417394/439893732843877347520191106-32001-1v6txak.pdf?v=1573077224
17. Thakur M, Khushboo YA, Dubey KK, Dakal TC, Yadav V. Antimicrobial activity against antibiotic-resistant pathogens and antioxidant activity and LCMS/MS phytochemical content analysis of selected medicinal plants [Internet]. J Pure Appl Microbiol. 2024;18(1):722-38. DOI: https://doi.org/10.22207/JPAM.18.1.62
18. Serquén LM, Mantilla MCM, Osores SAI. Susceptibilidad de «Candida albicans» a extracto etanólico de cáscara de «Punica granatum» [Internet]. Med Natur. 2020 [acceso: 19/06/2025]; 14(1):59-64. Disponible en: https://dialnet.unirioja.es/servlet/articulo?codigo=7248977
19. Faujdar SS, Bisht D, Sharma A. Antibacterial activity of Syzygium aromaticum (clove) against uropathogens producing ESBL, MBL, and AmpC beta-lactamase: Are we close to getting a new antibacterial agent? [Internet]. J Fam Med Prim Care. 2020 [acceso: 21/06/2025]; 9(1):180-6. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7014883/
20. Kupnik K, Primožič M, Vasić K, Knez Ž, Leitgeb M. A Comprehensive Study of the antibacterial activity of bioactive juice and extracts from pomegranate (Punica granatum L.) Peels and Seeds [Internet]. Plants. 2021 [acceso: 19/06/2025]; 10(8):1554. Disponible en: https://pubmed.ncbi.nlm.nih.gov/34451599/
21. Troncoso C, Pavez M, Santos A, Salazar R, Barrientos L, Troncoso C, et al. Implicancias estructurales y fisiológicas de la célula bacteriana en los mecanismos de resistencia antibiótica [Internet]. Int J Morphol. 2017 [acceso: 23/06/2025]; 35(4):1214-23. Disponible en: https://www.scielo.cl/scielo.php?pid=S0717-95022017000401214&script=sci_arttext
22. Ghai I. Una barrera de entrada: Análisis de la membrana externa bacteriana y la resistencia a los antibióticos [Internet]. Ciencias Aplicadas. 2023 [acceso: 23/06/2025]; 13(7): 4238. DOI: https://doi.org/10.3390/app13074238
23. Scaglione E, Sateriale D, Mantova G, Di Rosario M, Continisio L, Vitiello M, et al. Antimicrobial efficacy of Punica granatum Lythraceae peel extract against pathogens belonging to the ESKAPE group [Internet]. Front Microbiol. 2024;15: 1383027. DOI: https://doi.org/10.3389/fmicb.2024.1383027
24. Maggini V, Semenzato G, Gallo E, Nunziata A, Fani R, Firenzuoli F. Antimicrobial activity of Syzygium aromaticum essential oil in human health treatment [Internet]. Molecules. 2024; 29(5): 999. DOI: https://doi.org/10.3390/molecules29050999
25. Noreen S, Hashmi B, Aja PM, Atoki AV. Phytochemicals and pharmacology of pomegranate (Punica granatum L.): nutraceutical benefits and industrial applications: a review [Internet]. Front Nutr. 2025;12: 1528897. DOI: https://doi.org/10.3389/fnut.2025.1528897
26. Vivot EP, Sánchez C, Cacik F, Sequin C. Actividad antibacteriana en plantas medicinales de la flora de Entre Ríos (Argentina) [Internet]. Cienc Docencia Tecnol. 2012 [acceso: 19/06/2025]; 45:131-46. Disponible en: https://www.scielo.org.ar/scielo.php?pid=S1851-17162012000200008&script=sci_arttext&tlng=pt
27. Martínez SM, Jiménez M del C, García PE, Figueroa M, Maceiras MA, Martínez SM, et al. Actividad cicatrizante in vivo del polvo carbonizado de Punica granatum Linn y Eichhornia crassipes [Internet]. Rev Cuba Med Mil. 2019 [acceso: 21/06/2025]; 48(2):166-76. Disponible en: http://scielo.sld.cu/pdf/mil/v48n2/1561-3046-mil-48-02-e284.pdf
28. Qian W, Sun Z, Wang T, Yang M, Liu M, Zhang J, et al. Antimicrobial activity of eugenol against carbapenem-resistant Klebsiella pneumoniae and its effect on biofilms [Internet]. Microb Pathog. 2020 [acceso: 21/06/2025]; 139: 103924. Disponible en: https://www.sciencedirect.com/science/article/abs/pii/S0882401019316948?via%3Dihu
29. Ginting EV, Retnaningrum E, Widiasih DA. Antibacterial activity of clove (Syzygium aromaticum) and cinnamon (Cinnamomum burmannii) essential oil against extended-spectrum β-lactamase-producing bacteria [Internet]. Vet World. 2021 [acceso: 21/06/2025];14(8):2206-11. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8448639/
Conflictos de interés
Los autores declaramos que no existe conflicto de interés.
Información financiera
La investigación fue financiada con recursos propios.
Contribuciones de los autores
Conceptualización: Cinthya Yanina Santa Cruz López, José Ernesto Romero – Flores, Elizabeth Sarai Villegas – Manay, Mario Moreno – Mantilla, Fransk Carrasco-Solano.
Curación de datos: Cinthya Yanina Santa Cruz López, José Ernesto Romero – Flores, Elizabeth Sarai Villegas – Manay, Mario Moreno – Mantilla, Fransk Carrasco-Solano.
Análisis formal: Cinthya Yanina Santa Cruz López, José Ernesto Romero – Flores, Elizabeth Sarai Villegas – Manay, Mario Moreno – Mantilla, Fransk Carrasco-Solano.
Adquisición de fondos: Cinthya Yanina Santa Cruz López, José Ernesto Romero – Flores, Elizabeth Sarai Villegas – Manay, Mario Moreno – Mantilla, Fransk Carrasco-Solano.
Investigación: Cinthya Yanina Santa Cruz López, José Ernesto Romero- Flores, Elizabeth Sarai Villegas-Manay, Mario Moreno-Mantilla, Fransk Carrasco-Solano.
Metodología: Cinthya Yanina Santa Cruz López, José Ernesto Romero - Flores, Elizabeth Sarai Villegas-Manay, Mario Moreno-Mantilla, Fransk Carrasco-Solano.
Administración de proyecto: Cinthya Yanina Santa Cruz López, José Ernesto Romero-Flores, Elizabeth Sarai Villegas-Manay, Mario Moreno-Mantilla, Fransk Carrasco-Solano.
Recursos: Cinthya Yanina Santa Cruz López, José Ernesto Romero-Flores, Elizabeth Sarai Villegas-Manay, Mario Moreno-Mantilla, Fransk Carrasco-Solano.
Software: Cinthya Yanina Santa Cruz López, José Ernesto Romero-Flores, Elizabeth Sarai Villegas-Manay, Mario Moreno-Mantilla, Fransk Carrasco-Solano.
Supervisión: Cinthya Yanina Santa Cruz López, Mario Cecilio Moreno Mantilla, Fransk Carrasco Solano.
Validación: Cinthya Yanina Santa Cruz López, José Ernesto Romero-Flores, Elizabeth Sarai Villegas-Manay, Mario Moreno-Mantilla, Fransk Carrasco-Solano.
Visualización: Cinthya Yanina Santa Cruz López, José Ernesto Romero-Flores, Elizabeth Sarai Villegas-Manay, Mario Moreno-Mantilla, Fransk Carrasco-Solano.
Redacción - borrador original: Cinthya Yanina Santa Cruz López, José Ernesto Romero-Flores, Elizabeth Sarai Villegas-Manay, Mario Moreno-Mantilla, Fransk Carrasco-Solano.
Redacción - revisión y edición: Cinthya Yanina Santa Cruz López, José Ernesto Romero-Flores, Elizabeth Sarai Villegas-Manay, Mario Moreno-Mantilla, Fransk Carrasco-Solano.
Declaración de disponibilidad de datos
Datos de investigación disponibles en archivo complementario (Excel 2016). Disponible en: https://revmedmilitar.sld.cu/index.php/mil/libraryFiles/downloadPublic/117