Artículo de Revisión
Rol del flujograma de venas pulmonares en la predicción de cardiotoxicidad por quimioterapia
The role of pulmonary vein flowmetry in predicting chemotherapy-induced cardiotoxicity
Luis Germán Ramírez Domínguez1 https://orcid.org/0009-0007-0486-8914
Julio Alberto Pérez Domínguez1* https://orcid.org/0000-0002-6626-0484
1Universidad de Ciencias Médicas de Granma. Hospital Provincial General “Carlos Manuel de Céspedes”. Granma, Cuba.
*Autor para la correspondencia. Correo electrónico: jualped.grm@infomed.sld.cu
RESUMEN
Antecedentes: La cardiotoxicidad inducida por quimioterapia puede manifestarse con disfunción diastólica e insuficiencia cardiaca con fracción de eyección preservada. La evaluación ecocardiográfica de la función diastólica incluye el flujo mitral, el Doppler tisular y el flujograma de venas pulmonares, aunque su valor predictivo en este contexto es motivo de controversia.
Objetivo: Analizar y sintetizar la evidencia científica disponible sobre el papel del flujograma de venas pulmonares como herramienta ecocardiográfica para la detección temprana de cardiotoxicidad inducida por quimioterapia y su aplicabilidad en contextos clínicos de bajos recursos.
Métodos: Se realizó una revisión bibliográfica narrativa de artículos originales y revisiones publicadas en los últimos 10 años en PubMed, SciELO y Scopus, que evaluaran la función diastólica y enfocada en el valor actual del flujograma de venas pulmonares como predictor de cardiotoxicidad inducida por quimioterapia.
Desarrollo: El flujograma de venas pulmonares puede detectar elevación precoz de las presiones de llenado y rigidez ventricular izquierda antes de la caída de la fracción de eyección. Es una herramienta ecocardiográfica prometedora para la detección precoz de cardiotoxicidad. No obstante, su uso rutinario se ve limitado por la complejidad técnica, baja reproducibilidad y disponibilidad reducida en entornos de bajos recursos, en los cuales el Doppler mitral y tisular son más accesibles y validados.
Conclusiones: El flujograma de venas pulmonares representa un parámetro prometedor desde el punto de vista fisiopatológico, capaz de reflejar alteraciones hemodinámicas tempranas en la función auriculoventricular que orientan hacia la disfunción diastólica y a la cardiotoxicidad.
Palabras clave: cardiotoxicidad; Doppler tisular; ecocardiografía; flujograma de venas pulmonares; función diastólica; quimioterapia.
ABSTRACT
Background: Chemotherapy-induced cardiotoxicity may manifest as diastolic dysfunction and heart failure with preserved ejection fraction. Echocardiographic assessment of diastolic function includes mitral inflow, tissue Doppler, and pulmonary vein flow, although their predictive value in this context remains controversial.
Objective: To analyze and synthesize the available scientific evidence on the role of pulmonary vein flow as an echocardiographic tool for the early detection of chemotherapy-induced cardiotoxicity and to evaluate its applicability in low-resource clinical settings.
Methods: A narrative literature review was conducted of original articles and reviews published in the last 10 years in PubMed, SciELO, and Scopus, focusing on diastolic function and the current value of pulmonary vein flow as a predictor of chemotherapy-induced cardiotoxicity.
Development: Pulmonary vein flow can detect early elevation of filling pressures and left ventricular stiffness before a decline in ejection fraction occurs. It is a promising echocardiographic tool for the early detection of cardiotoxicity. However, its routine use is limited by technical complexity, low reproducibility, and limited availability in low-resource settings, where mitral and tissue Doppler are more accessible and validated.
Conclusions: Pulmonary vein flow represents a physiopathologically promising parameter capable of reflecting early hemodynamic alterations in atrioventricular function, guiding the detection of diastolic dysfunction and cardiotoxicity.
Keywords: cardiotoxicity; chemotherapy; diastolic function; tissue Doppler; pulmonary vein flow; echocardiography.
Recibido: 10/11/2025
Aprobado: 15/12/2025
INTRODUCCIÓN
La detección precoz de la disfunción cardíaca inducida por quimioterapia continúa siendo uno de los principales retos de la cardiooncología contemporánea. A pesar de los avances en imagen cardiovascular, el diagnóstico de cardiotoxicidad se basa predominantemente en la reducción de la fracción de eyección del ventrículo izquierdo (FEVI), un marcador tardío y de baja sensibilidad para detectar daño subclínico.(1,2) En este contexto, el interés se ha desplazado hacia técnicas capaces de identificar alteraciones funcionales tempranas, entre ellas la deformación miocárdica, (strain longitudinal global, GLS), y los parámetros de función diastólica.
La evaluación de la función diastólica del ventrículo izquierdo (VI) constituye un pilar fundamental en la práctica cardiológica. El estudio de esta variable tras la aplicación de quimioterapia subraya la importancia de evaluar no solo la FEVI sino también parámetros de llenado, relajación y distensibilidad miocárdica, lo que podría dar espacio a incorporar flujograma de venas pulmonares como variable de interés.(3) Entre los métodos más utilizados se encuentran el flujograma mitral, el Doppler tisular (TDI), y el flujograma de venas pulmonares (FVP). Cada técnica posee ventajas, limitaciones y controversias sobre su aplicabilidad y precisión en diferentes contextos clínicos.(4,5)
La presente investigación tiene como objetivo analizar y sintetizar la evidencia científica disponible sobre el papel del flujograma de venas pulmonares como herramienta ecocardiográfica para la detección temprana de cardiotoxicidad inducida por quimioterapia y evaluar su aplicabilidad en contextos clínicos de bajos recursos.
MÉTODOS
Tipo de estudio: se realizó una revisión bibliográfica narrativa, enfocada en el valor actual del FVP como predictor de cardiotoxicidad inducida por quimioterapia.
Fuentes de información: se efectuó una búsqueda exhaustiva de artículos originales, revisiones sistemáticas, metaanálisis y guías de práctica clínica publicadas entre enero de 2013 y septiembre de 2025, en las bases de datos PubMed/MEDLINE, Scopus y SciELO.
Estrategia de búsqueda: se utilizaron los descriptores MeSH y DeCS combinados mediante operadores booleanos: ("cardiotoxicity" OR "chemotherapy-induced cardiotoxicity") AND ("diastolic function" OR "pulmonary venous flow" OR "tissue Doppler" OR "mitral inflow" OR "echocardiography").
Los resultados se filtraron por idioma (inglés y español) y estudios realizados en humanos adultos.
Criterios de inclusión:
Estudios que evaluaran la función diastólica mediante Doppler mitral, tisular o de venas pulmonares en pacientes tratados con quimioterapia.
Investigaciones que analizan la relación entre estos parámetros y la aparición de disfunción ventricular o cardiotoxicidad.
Publicaciones en revistas arbitradas con texto completo disponible.
Criterios de exclusión:
Estudios experimentales en animales o modelos celulares.
Series de casos con menos de 10 pacientes.
Trabajos sin datos ecocardiográficos cuantitativos o sin análisis de función diastólica.
Procedimiento de revisión y análisis: dos autores realizaron de forma independiente la selección inicial por título y resumen. Los artículos seleccionados se revisaron en texto completo, extrayendo datos sobre el tipo de quimioterapia, técnica ecocardiográfica, parámetros diastólicos evaluados y desenlaces clínicos. Las discrepancias se resolvieron por consenso.
Síntesis de la información: la información se organizó según el tipo de parámetro diastólico (flujograma mitral, TDI, FVP) y su valor pronóstico. Se realizó una comparación cualitativa de las ventajas, limitaciones y aplicabilidad en contextos de bajos recursos, especialmente en entornos latinoamericanos.
DESARROLLO
Aportes de cada técnica en la evaluación de la función diastólica
1. Flujograma mitral, tiempo de desaceleración, tiempo de relajación isovolumétrica: evalúa el patrón de llenado transmitral. Permite valorar la velocidad de llenado diastólico y calcular índices como E/A y deceleración de la onda E. Es el pilar clásico de la valoración diastólica. Su principal ventaja es la disponibilidad y facilidad de interpretación. Sin embargo, se ve afectado por la frecuencia cardíaca y la precarga.(6)
2. Doppler tisular (TDI): evalúa la velocidad de movimiento del anillo mitral, ofreciendo información sobre la relajación miocárdica y la presión de llenado del ventrículo izquierdo. Es menos dependiente de la precarga y puede detectar disfunción diastólica precoz. Reduce parte de la dependencia de la precarga; por ello suele ser más reproducible y valiosa para estimar presiones de llenado.(7)
3. Flujograma de venas pulmonares (FVP): analiza las ondas sistólica y diastólica en venas pulmonares, reflejando la presión auricular izquierda y la interacción entre aurícula y ventrículo.(8) Aunque aporta datos complementarios, su obtención puede ser técnicamente más desafiante y menos reproducible. Esto explica la heterogeneidad de resultados en cardiotoxicidad.
Limitaciones y controversias
Ninguna técnica puede considerarse totalmente superior; cada una está condicionada por factores hemodinámicos y técnicos.
En pacientes con disfunción diastólica temprana, el TDI puede detectar alteraciones que el flujograma mitral no evidencia.
El flujograma de venas pulmonares, aunque útil en casos complejos, no siempre añade información clínica adicional frente a TDI y Doppler mitral.
La variabilidad interobservador y la influencia de la precarga son factores críticos en la interpretación de todas las técnicas.
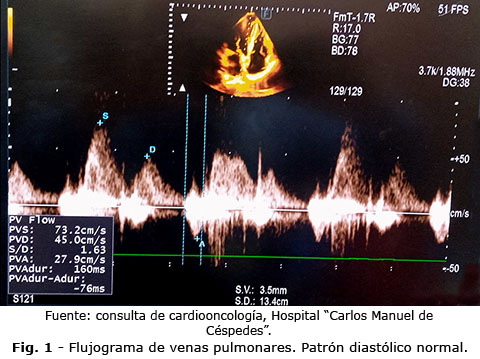
La estimación del FVP mediante Doppler pulsado ha sido históricamente empleada para valorar la función diastólica y la interacción auriculoventricular. El patrón normal muestra dos ondas principales: una sistólica (S) y una diastólica (D), seguidas de una reversa auricular (Ar). Las modificaciones de la relación S/D y la prolongación de la onda Ar se correlacionan con el aumento de la presión de llenado y la rigidez del ventrículo izquierdo (Fig. 1). Por tanto, teóricamente, el FVP podría reflejar cambios tempranos en la función de llenado antes de la alteración de la FEVI o del GLS en pacientes expuestos a quimioterapia cardiotóxica.(9,10)
Sin embargo, la reproducibilidad del FVP ha sido cuestionada debido a su dependencia del ángulo de insonación, de las condiciones de precarga y de la calidad técnica del registro, lo cual ha limitado su adopción generalizada. Además, la evidencia actual proviene de estudios con pequeño tamaño muestral y sin validación pronóstica a largo plazo. Investigaciones recientes no han demostrado un valor independiente del FVP frente a parámetros como el GLS o la relación E/e′.(11,12)
Aún así, su valor fisiopatológico potencial no debe subestimarse. En la era de la cardiotoxicidad con FEVI preservada, la identificación de disfunción diastólica precoz es crucial para intervenir antes de la aparición de síntomas.(3,4) La integración del FVP dentro de un modelo multimodal que combine GLS, biomarcadores (troponina, NT-proBNP) y medidas de presión de llenado, como el flujograma transmitral y el TDI, podría mejorar la estratificación del riesgo y la predicción de insuficiencia cardiaca con fracción de eyección preservada (ICFEp) en supervivientes de cáncer. Estudios como Fawzy AA y otros(13) demuestran que la evaluación con técnicas ecocardiográficas avanzadas (strain, 3D, enfoque del ventrículo derecho) sigue en expansión, aunque no analizan explícitamente flujo de venas pulmonares, refuerzan la necesidad de multimodalidad(13) (Fig. 2).
El algoritmo de 2016 de la Sociedad Americana de Ecocardiografía (ASE)/Asociación Europea de Imagen Cardiovascular (EACVI) otorgó al FVP papel secundario para evaluar la presión de llenado del ventrículo izquierdo.(14) En la práctica clínica, en pacientes con cáncer de mama tratadas con antraciclinas, se observó una disminución progresiva de la onda S y una inversión del patrón S/D en aquellas que desarrollaron cardiotoxicidad subclínica, sugiriendo un potencial valor pronóstico temprano, sin embargo, el FVP no es recomendada como variable única para estimar disfunción diastólica.
La figura 3 confirma la aseveración anterior, en ella se muestra el FVP con inversión de la relación S/D y prolongación de la duración de la onda Ar lo que evidencia un patrón de disfunción diastólica grave en una paciente con cáncer de mama, al tercer mes de recibir quimioterapia con antraciclinas y taxoles. La figura 4 muestra el Doppler tisular del anillo medial de la misma paciente, refleja elevación significativa de la relación E/e’ lo que traduce incremento de las presiones de llenado.
El estudio de Palmiero P y otros(15) al analizar la metodología utilizada para la evaluación de la función diastólica en pacientes con fibrilación auricular, destaca que la prolongación de la onda Ar se asocia con elevaciones concomitantes de troponina I y con una reducción posterior del GLS. Lamentablemente, los estudios que evalúan específicamente el FVP en pacientes oncológicos son prácticamente inexistentes. No obstante, las investigaciones de Cho I y otros,(16) Sampaio DPS y otros,(17) Scalia IG y otrso(18) y Niu H y otros,(19) ofrecen una perspectiva estructurada sobre el papel de la imagen cardiovascular en la vigilancia y detección temprana de la cardiotoxicidad mediante ecocardiografía convencional y avanzada, aportando así un marco contextual sobre la relevancia del seguimiento seriado por imagen (Fig. 4).
La cardiotoxicidad inducida por quimioterapia representa un espectro clínico que abarca desde la disfunción subclínica hasta la insuficiencia cardíaca establecida. Tradicionalmente, la vigilancia se ha centrado en la FEVI, aunque hoy se reconoce que un número creciente de pacientes desarrollan ICFEp, en la cual la disfunción diastólica desempeña un papel central en la génesis de los síntomas y del deterioro funcional.(20)
Los mecanismos implicados incluyen estrés oxidativo, inflamación y fibrosis intersticial inducidos por antraciclinas, trastuzumab y otros agentes dirigidos, que alteran la distensibilidad miocárdica y la relajación ventricular antes de comprometer la contractilidad.
En este contexto, los índices diastólicos ecocardiográficos, como la relación E/e′, el volumen auricular izquierdo y el FVP, ofrecen una aproximación fisiopatológica temprana a los cambios de llenado ventricular y a la elevación de las presiones telediastólicas.(10,11) No obstante, el papel del FVP como predictor de disfunción diastólica por cardiotoxicidad no ha sido evaluado y su uso prácticamente esta desestimado. Estos resultados dispares pueden explicarse por múltiples factores metodológicos: la alta variabilidad interobservador, la dependencia del ángulo de insonación, las condiciones de precarga, la influencia de la frecuencia cardíaca y la necesidad de obtener una señal Doppler de alta calidad en venas pulmonares derechas, lo que limita la reproducibilidad.
Las Guías de Cardiooncología de la Sociedad Europea de Cardiología (ESC 2022)(21) y la Sociedad Americana de Ecocardiografia,(22) no incluyen el FVP dentro de las herramientas recomendadas para la monitorización de la función diastólica o la estratificación de riesgo. En su lugar, se enfatiza la integración de parámetros convencionales (E/e′, volumen auricular izquierdo, velocidad e′) y el uso del GLS como marcador sensible de disfunción ventricular precoz. Este posicionamiento refleja el consenso actual: el FVP ofrece una visión fisiológica interesante, pero carece aún de validez pronóstica demostrada y de protocolos estandarizados para su interpretación en el contexto de la cardiotoxicidad inducida por quimioterapia.
El FVP representa un parámetro prometedor desde el punto de vista fisiopatológico, capaz de reflejar alteraciones hemodinámicas tempranas en la función auriculoventricular. No obstante, su papel clínico en la predicción de cardiotoxicidad sigue siendo controvertido. Se requieren estudios prospectivos, multicéntricos y con integración multimodal (ecocardiografía avanzada, biomarcadores y resonancia magnética) para definir su valor pronóstico y su posible incorporación a los algoritmos de estratificación de riesgo en Cardiooncología.
La principal limitación de esta revisión narrativa es la ausencia de estudios que evalúen de manera directa el papel del FVP como predictor de cardiotoxicidad, lo que limita la posibilidad de establecer puntos de corte, parámetros de referencia y algoritmos pronósticos validados para esta población. Asimismo, la naturaleza narrativa de la revisión implica un riesgo inherente de sesgo de selección, dado que la identificación y síntesis de la evidencia dependen en gran medida de la disponibilidad y calidad de los estudios incluidos. Además, la escasez de literatura específica obliga a integrar hallazgos provenientes de poblaciones con características distintas, lo cual puede limitar la generalización de las conclusiones.
El flujograma de venas pulmonares es un marcador ecocardiográfico sensible para la detección temprana de alteraciones diastólicas en pacientes sometidos a quimioterapia. Las variaciones en las ondas S, D y Ar, así como en la relación S/D, pueden anticipar la aparición de cambios en la fracción de eyección del ventrículo izquierdo. Cuando se integra con parámetros de deformación miocárdica y biomarcadores cardíacos, el FVP fortalece la vigilancia clínica y contribuye a la identificación y prevención de disfunción ventricular subclínica.
REFERENCIAS BIBLIOGRÁFICAS
1. Fadel MB, Pibarot P, Kazzi BE, Al-Admawi M, Galzerano D, Alhumaid M, et al. Spectral doppler interrogation of the pulmonary veins for the diagnosis of cardiac disorders: a comprehensive review [Internet]. J Am Soc Echocardiogr. 2021; 34 (3): 223-36. DOI: https://doi.org/10.1016/j.echo.2020.09.012
2. Edpuganti S, Puthooran DM, Jape T, Staisy Mariyam Soju SM. Cardiac Toxicity of Cancer Therapies: Mechanisms, Surveillance, and Clinical Implications [Internet]. Int J Cardiovasc Acad. 2025; 11(3):97-106. DOI: https://doi.org/10.4274/ijca.2025.3935
3. Rashid H, Rashid A, Mattoo A, Guru FR, Mehvish S, Kakroo SA, et al. Left ventricular diastolic function and cardiotoxic chemotherapy [Internet]. Egypt Heart J. 2024; 76(1):45. DOI: https://doi.org/10.1186/s43044-024-00476-4
4. Anthony C, Akintoye E, Wang T, Klein A. Echo Doppler Parameters of Diastolic Function [Internet]. Curr Cardiol Rep. 2023; 25(4):235-47. DOI: https://doi.org/10.1007/s11886-023-01844-3
5. Sorrentino R, Esposito R, Santoro C, Vaccaro A, Cocozza S, Scalamogna M, et al. Practical impact of new diastolic recommendations on noninvasive estimation of left ventricular diastolic function and filling pressures [Internet]. J Am Soc Echocardiogr. 2020; 33(2):171-81. DOI: https://doi.org/10.1016/j.echo.2019.08.013
6. Nagueh SF. Left ventricular diastolic function: understanding pathophysiology, diagnosis, and prognosis with echocardiography [Internet]. JACC Cardiovasc Imaging. 2020; 13(1 Pt 2):228-44. DOI: https://doi.org/10.1016/j.jcmg.2018.10.038
7. Rusinaru D, Bohbot Y, Djelaili F, Delpierre Q, Altes A, Serbout S, et al. Normative Reference Values of Cardiac Output by Pulsed-Wave Doppler Echocardiography in Adults [Internet], Am J Cardiol. 2021; 140:128-33. DOI: https://doi.org/10.1016/j.amjcard.2020.10.046
8. Smiseth OA. Pulmonary veins: an important side window into ventricular function [Internet]. Eur Heart J Cardiovasc Imaging. 2015;16(11):1189-90. DOI: https://doi.org/10.1093/ehjci/jev149
9. Lindow T, Manouras A, Lindqvist P, Manna D, Wieslander B, Kozor R, et al. Echocardiographic estimation of pulmonary artery wedge pressure: invasive derivation, validation, and prognostic association beyond diastolic dysfunction grading [Internet]. Eur Heart J Cardiovasc Imaging. 2024; 25(4):498-509. DOI: https://doi.org/10.1093/ehjci/jead301
10. Mincu RI, Lampe LF Mahabadi AA, Kimmig R, Rassaf T, Totzec, M, et al. Left ventricular diastolic function following anthracycline-based chemotherapy in patients with breast cancer without previous cardiac disease. A meta-analysis [Internet]. J Clin Med. 2021; 10(17):3890. DOI: https://doi.org/10.3390/JCM10173890
11. Chan N, Ming Wang TK, Anthony C, Abou Hassan O, Chetrit M, Dillenbeck A, et al. Echocardiographic evaluation of diastolic function in special populations [Internet]. Am J Cardiol. 2023 [acceso: 08/06/2025]; 202: 131-43. Disponible en: https://doi.org/10.1016/j.amjcard.2023.05.032
12. Aslanger E, Yıldırımtürk Ö, Akaslan D, Öz M, Güngör B, Ataş H, et al. Which diastolic pressure should be used to assess diastolic function? [Internet]. Anatol J Cardiol. 2024; 28(3):158-64. DOI: https://doi.org/10.14744/AnatolJCardiol.2024.3713
13. Fawzy AA, El-Menyawi KA, Sallam WM, Zahran ME. Two-dimensional speckle tracking echocardiography in chemotherapy-induced cardiotoxicity in females with breast cancer [Internet]. Cardiooncology. 2024; 10(1):13. DOI: https://doi.org/10.1186/s40959-024-00209-1
14. Güvenç TS, Poyraz E, Çetin Güvenç R, Can F. Contemporary usefulness of pulmonary venous flow parameters to estimate left ventricular end-diastolic pressure on transthoracic echocardiography. Int J Cardiovasc Imaging. 2020;36(9):1699-1709. DOI: https://doi.org/10.1007/s10554-020-01886-6
15. Palmiero P, Caretto P, Zito A, Matteo Ciccone M, Pelliccia F, Maiello M, et al. Left ventricular diastolic function in atrial fibrillation: Methodological implications and clinical considerations [Internet]. Echocardiography. 2024; 41(4): e15818. DOI: https://doi.org/10.1111/echo.15818
16. Cho I, You SC, Cha MJ, Hwang HJ, Cho EJ, Kim HJ, et al. Cancer therapy-related cardiac dysfunction and the role of cardiovascular imaging: systemic review and opinion paper from the Working Group on Cardio-Oncology of the Korean Society of Cardiology [Internet]. J Cardiovasc Imaging. 2024;32(1):13. DOI: https://doi.org/10.1186/s44348-024-00014-5
17. Sampaio DPS, Silva JBM, do Carmo Rassi D, Freitas AF Jr, Rassi S. Echocardiographic strategy for early detection of cardiotoxicity of doxorubicin: a prospective observational study [Internet]. Cardiooncology. 2022;8(1):17. DOI: https://doi.org/10.1186/s40959-022-00143-0
18. Scalia IG, Gheyath B, Tamarappoo BK, Moudgil R, Otton J, Pereyra M, et al. Chemotherapy related cardiotoxicity evaluation. A contemporary review with a focus on cardiac imaging [Internet]. J Clin Med. 2024; 13(13):3714. DOI: https://doi.org/10.3390/jcm13133714
19. Niu H, Ma Z, Yang S, Shen X, Ding H, Yuan F. Two-dimensional speckle tracking imaging and tissue Doppler imaging can predict subclinical left ventricular systolic and diastolic dysfunctions after chemotherapy for breast cancer [Internet]. Am J Transl Res. 2025; 17(2):1087-96. DOI: https://doi.org/10.62347/GWCJ5941
20. Suleman M, Saqib M, Mumtaz H, Iftikhar M, Raza A, Rauf Butt S, et al. Novel echocardiographic markers for left ventricular filling pressure prediction in heart failure with preserved ejection fraction (ECHO-PREDICT): a prospective cross-sectional study [Internet]. Ann Med Surg (Lond). 2023; 85(11):5384-95. DOI: https://doi.org/10.1097/MS9.0000000000001287
21. Lyon AR, López-Fernández T, Couch LS, Asteggiano R, Aznar MC, Bergler-Klein J, et al. 2022 ESC Guidelines on cardio-oncology developed in collaboration with the European Hematology Association (EHA), the European Society for Therapeutic Radiology and Oncology (ESTRO) and the International Cardio-Oncology Society (IC-OS) [Internet]. Eur Heart J. 2022; 43(41):4229-4361. DOI: https://doi.org/10.1093/eurheartj/ehac244
22. Nagueh SF, Sanborn DY, Oh JK, Anderson B, Billick K, Derumeaux G, et al. Recommendations for the evaluation of left ventricular diastolic function by echocardiography and for heart failure with preserved ejection fraction diagnosis: an update from the American Society of Echocardiography. [Internet]. J Am Soc Echocardiogr. 2025; 38(7):537-69. DOI: https://doi.org/10.1016/j.echo.2025.03.011
Conflictos de interés
Los autores declaran no tener conflictos de interés.
Información financiera
No existió financiamiento externo.
Contribuciones de los autores
Conceptualización: Luis Germán Ramírez Domínguez, Julio Alberto Pérez Domínguez.
Curación de datos: Luis Germán Ramírez Domínguez.
Análisis formal: Luis Germán Ramírez Domínguez, Julio Alberto Pérez Domínguez.
Investigación: Luis Germán Ramírez Domínguez, Julio Alberto Pérez Domínguez.
Metodología: Luis Germán Ramírez Domínguez, Julio Alberto Pérez Domínguez.
Recursos: Luis Germán Ramírez Domínguez, Julio Alberto Pérez Domínguez.
Supervisión: Luis Germán Ramírez Domínguez.
Validación: Luis Germán Ramírez Domínguez, Julio Alberto Pérez Domínguez.
Visualización: Luis Germán Ramírez Domínguez, Julio Alberto Pérez Domínguez.
Redacción – borrador original: Luis Germán Ramírez Domínguez, Julio Alberto Pérez Domínguez.
Redacción – revisión y edición: Luis Germán Ramírez Domínguez, Julio Alberto Pérez Domínguez.
Disponibilidad de datos
No hay datos asociados con este artículo.