Revisión Sistemática
Probióticos en el tratamiento de los síntomas del síndrome
del intestino irritable
Probiotics in the treatment of symptoms of irritable bowel syndrome
Ana Flavia Naomy Paredes Cancino1
https://orcid.org/0000-0002-1288-8698
Merlin
Goretti Alonzo De La Cruz1
https://orcid.org/0000-0003-1668-2969
Jorge
Luis Díaz-Ortega1
https://orcid.org/0000-0002-6154-8913
1Universidad
César Vallejo. Escuela Profesional de Nutrición. Trujillo, Perú.
*Autor para la correspondencia. Correo electrónico:
jdiazo@ucv.edu.pe
RESUMEN
Introducción:
El síndrome del intestino irritable es un trastorno digestivo frecuente
en personas menores de 50 años, caracterizado por dolor abdominal, estreñimiento
y diarrea.
Objetivo: Analizar el efecto de los probióticos sobre los síntomas
clínicos del síndrome del intestino irritable en pacientes adultos.
Métodos: Se realizó una revisión de alcance, con el uso de la base
de datos de la biblioteca virtual de la Universidad César Vallejo, que incluyó
Scopus, PubMed, Proquest y EbscoHost. utilizando como términos de búsqueda
a probióticos, síndrome de intestino irritable y tipo de estudio Se seleccionaron
estudios publicados entre 2016 y junio 2021; en cualquier idioma y que involucraran
pacientes mayores de 16 años, con diagnóstico de SII según los criterios de
ROMA III y/o ROMA IV y que incluyeran suplementación con probióticos. Se excluyeron
gestantes y aquellos con cambios de la medicación antes o durante la ejecución
del estudio. Se encontraron 4989 artículos y se seleccionaron 18 ensayos clínicos.
Resultados:
Los probióticos más utilizados fueron Lactobacillus, Bifidobacterium
y Bacillus coagulans, además en 13 de 18 estudios se demostró
una mejora del dolor abdominal, la diarrea, estreñimiento o hinchazón abdominal
del síndrome del intestino irritable, la duración del tratamiento osciló entre
4 y 16 semanas, y la dosis de los probióticos, administrados de manera individual
o en combinaciones de varias cepas, se encontró en el orden de 109
a 1010 UFC/día.
Conclusiones:
Los probióticos mejoran los síntomas del síndrome del intestino irritable
en los pacientes durante su tratamiento.
Palabras
clave: dolor abdominal; Lactobacillus; probióticos; síntomas; síndrome
del intestino irritable.
ABSTRACT
Introduction:
Irritable bowel syndrome is a common digestive disorder in people under 50
years of age, characterized by abdominal pain, constipation and diarrhea.
Objective: To analyze the effect of probiotics on the clinical symptoms
of irritable bowel syndrome in adult patients.
Methods: A scoping review was conducted using the database of the Virtual
Library of the Universidad César Vallejo, including Scopus, PubMed, Proquest
and EbscoHost, using probiotics, irritable bowel syndrome and type of study
as search terms. Studies published between 2016 and June 2021 were selected;
in any language, and included patients over 16 years of age with a diagnosis
of IBS according to ROME III and ROME IV criteria, and included probiotic
supplementation. Pregnant women and those with medication changes before or
during the study were excluded. We found 4989 articles and selected 18 clinical
trials.
Results: The most commonly used probiotics were Lactobacillus, Bifidobacterium and Bacillus coagulans, and 13 of 18 trials
showed improvement in abdominal pain, diarrhea, constipation or bloating in
irritable bowel syndrome. The duration of treatment ranged from 4 to 16 weeks,
and the dose of probiotics, administered individually or in multi-strain combinations,
was found to be in the order of 109 to 1010 CFU/day.
Conclusion: Probiotics improve the symptoms of irritable bowel syndrome
in patients during their treatment.
Keywords:
abdominal pain; irritable bowel syndrome; Lactobacillus; probiotics; symptoms.
Recibido: 16/04/2024
Aceptado:
20/02/2025
INTRODUCCIÓN
El síndrome del intestino irritable (SII) tiene manifestaciones crónicas como
dolores abdominales frecuentes, distensión causada por la alteración de la
consistencia y frecuencia de las heces en diarrea, estreñimiento y en muchas
ocasiones se presentan ambos síntomas, por lo cual el cambio de la consistencia
de las heces es constante.(1)
La prevalencia del SII en el mundo varía entre el 10 y 35 % según la población
y los criterios utilizados para su diagnóstico. Entre las causas y mecanismos
que explican el SII se considera a la predisposición genética, la inflamación
intestinal, la interacción del eje cerebro-intestino, el sobrecrecimiento
bacteriano, la intolerancia a la dieta y los trastornos psicológicos.(2)
El SII se clasifica en 4 subtipos según la forma predominante de las heces
o la frecuencia informada por el individuo: SII con estreñimiento (SII-E);
SII con diarrea (SII-D); SII con hábito intestinal mixto (SII-M); o SII no
clasificado (SII-U), en el que la forma o frecuencia de las deposiciones no
permite clasificar al paciente con precisión en los otros 3 subtipos.(3)
Los probióticos son microorganismos vivos que no son patógenos. Se sabe que
producen varios efectos beneficiosos, como alterar la respuesta inmune del
huésped en el tracto gastrointestinal y reducir el crecimiento de algunos
organismos patógenos, al mejorar el equilibrio microbiano. Estos pueden consumirse
en forma de alimentos y en suplementos dietéticos. Varias cepas se utilizan
como probióticos y estas incluyen: Lactobacillus Bifidobacterium
e incluso Saccharomyces.(4)
Los médicos sugieren que ciertos probióticos podrían aliviar los síntomas
del SII debido a su accesibilidad, seguridad y potencial beneficio. Sin embargo,
la elección específica de probióticos para el SII aún no está clara. Tanto
los profesionales de la salud como los pacientes tienen dudas sobre cuáles
probióticos son efectivos para tratar los trastornos digestivos. Estas dudas
se deben a que muchos probióticos en el mercado se venden como suplementos
alimenticios, a menudo sin pruebas claras de su eficacia.(5)
En esta revisión de alcance se considera como objetivo analizar el efecto
de los probióticos sobre los síntomas clínicos del SII en pacientes adultos.
MÉTODOS
La búsqueda de los estudios se realizó en las bases de datos siguientes: Scopus,
PubMed, EBSCO Host y ProQuest. Los términos de búsqueda se basaron en 3 aspectos:
Probióticos, síndrome de intestino irritable y tipo de estudio, con sus términos
MESH correspondientes, y el uso de operadores booleanos OR y AND (ver anexo
1).
Después de obtener los artículos encontrados por los buscadores se procedió
a agregar los registros de cada buscador en la página web https://www.myendnoteweb.com,
en la que se eliminaron los artículos duplicados, a través de la herramienta
búsqueda de duplicados.
El tamizaje de los artículos fue realizado por dos revisores independientes,
autores de esta revisión. Se eliminaron registros por título y resumen y la
elegibilidad estuvo basada en criterios con relación a la pregunta PICO (Patien,
Intervention, Comparison, Outcomes) en relación con la distensión abdominal,
diarrea, dolor abdominal y estreñimiento. Los artículos elegidos se ingresaron
en un cuadro resumen para mostrar el autor, año de aplicación y resultados
observados en los grupos de tratamiento con probióticos frente a placebo.
Los criterios de inclusión fueron:
-
Ensayos
clínicos aleatorizados y controlados
-
Publicados
entre 2016 y junio 2021
- Pacientes
> 16 años en los estudios
-
Que en la intervención se considerara la suplementación con probióticos
-
Diagnóstico de SII de acuerdo con los criterios de ROMA III y ROMA IV(6)
Los criterios de exclusión fueron:
-
Que
los participantes tomaran medicamentos que modifiquen los síntomas gastrointestinales,
exonerados solo cuando fuera por rescate de la sintomatología grave del
SII
-
Gestantes
-
Que
los participantes experimentaran cambios de medicación 4 semanas antes del
iniciado el estudio o durante su ejecución
-
Que
incluyeran participantes con cirugías por cáncer de colon
-
Estudios
retractados por la revista en la que se publicó
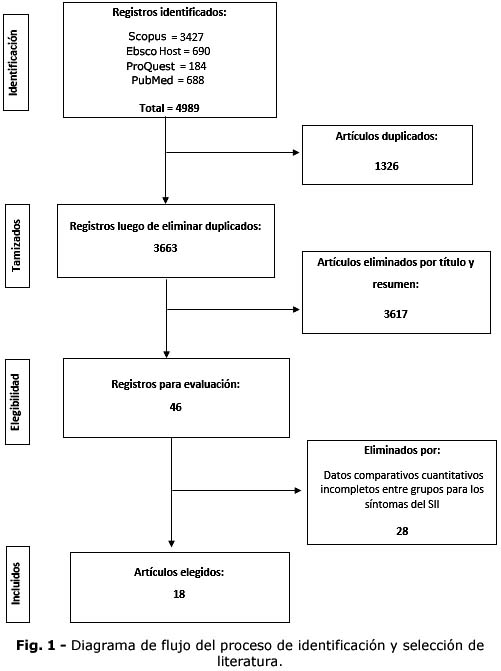
En la figura 1 se muestra el flujograma del proceso de selección de los artículos
para la discusión, de acuerdo con la guía de la declaración PRISMA 2020.(7)
De los 4989 artículos identificados, se seleccionaron 18 ensayos clínicos
doble ciego, de los cuales el 61,1 % se desarrollaron en Asia, principalmente
en India, Corea del Sur, China. Bangladesh e Israel y el 38,9 % en Europa,
principalmente en Italia, Polonia, Alemania, Eslovenia y Croacia.
RESULTADOS
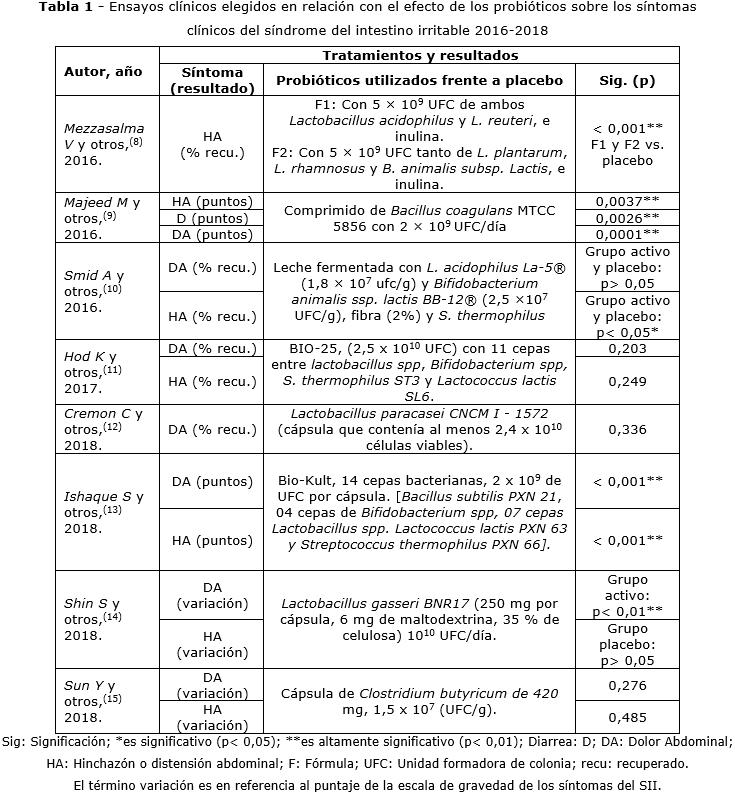
En la tabla 1 se muestra que los principales probióticos
para el tratamiento de la sintomatología del SII en el periodo del 2016 al
2018 fueron cepas de Lactobacillus evidenciado en 6 de 8 estudios (75
%) correspondiente a Mezzasalma V y otros,(8) Smid
A y otros,(10) Hod K y otros,(11)
Cremon C y otros,(12) Ishaque S y otros,(13)
Shin S y otros;(14) asimismo 4 ensayos clínicos de los 8 (50
%) indican la aplicación de Bifidobacterias observados en Mezzasalma
V y otros,(8) Smid A y otros,(10)
Hod K y otros,(11) Ishaque S y otros,(13)
3 estudios consideraron a Streptococcus thermophilus(10,11,13)
combinado con Lactobacillus y Bifidobacterium, 1 ensayo
clínico a Bacillus coagulans(9) y en 2 investigaciones utilizaron
Lactococcus lactis(11,13) como parte de una mezcla probiótica.
En 5 de los 8 ensayos clínicos (62,5 %) se encontró que mejoraron al menos
uno de los síntomas del SII de manera significativa.
Sun
Y y otros,(15) utilizaron Clostridium butyricum con una
dosis de 1,5 x 107 (UFC/g) y redujo significativamente la puntuación en la
escala de gravedad de los síntomas del SII (IBS-SSS) en el grupo probiótico
en comparación con el grupo placebo. Sin embargo, no hubo diferencia en las
puntuaciones de los componentes del dolor e hinchazón abdominal, por lo que
se requieren más investigaciones con este microorganismo.(15) Todos
los estudios(8,9,13) con un contenido en el orden de 109
UFC/día mejoraron al menos uno de los síntomas del SII, en comparación
con los tratamientos con contenidos en el orden de 107 y 1010
UFC/día que presentaron resultados contradictorios en relación con el beneficio
de los síntomas del SII.
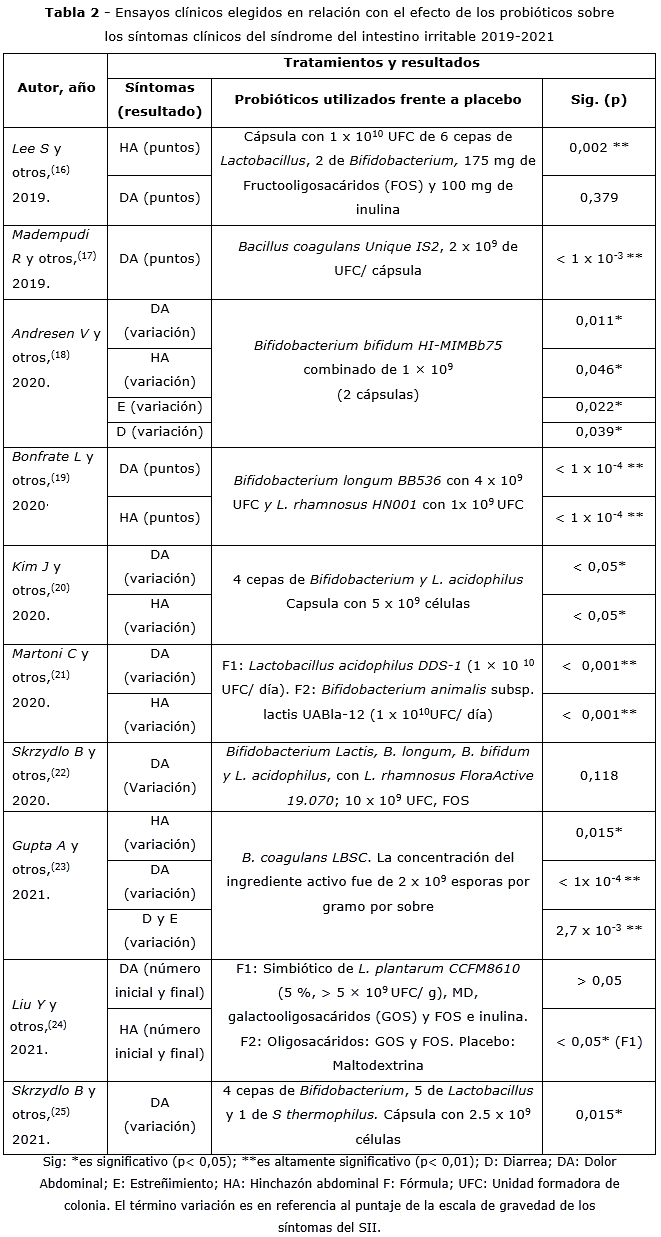
En
la tabla 2 durante el 2019 a 2021 se mantiene la tendencia
del uso de Lactobacillus en el tratamiento del SII, en 7 de los 10 estudios
(70 %) correspondiente a Lee S y otros,(16) Bonfrate L
y otros,(19) Kim J y otros,(20) Martoni C
y otros,(21) Skrzydlo B y otros,(22) Liu
Y y otros,(24) y Skrzydlo B y otros;(25) pero
también en igual proporción de estudios se aplicó Bifidobacterias en
Lee S y otros,(16) Andresen V y otros,(18)
Bonfrate L y otros,(19) Kim J y otros,(20)
Martoni C y otros,(21) Skrzydlo B y otros,(22)
y Skrzydlo B y otros;(25) este último consideró además
a S. thermophilus,(25, y 2 ensayos utilizaron B. coagulans.(17,23)
Se observó que 8 de 10 ensayos clínicos en este período (80 %) los pacientes
mejoraron al menos un síntoma del SII. También hay un estudio(21)
comparativo en el que L. acidophillus presentó mejor reducción de la
duración y la intensidad del dolor abdominal que B. animalis subs, lactis.
En cuanto al contenido de microorganismos considerado en el tratamiento del
SII en este periodo de los ensayos clínicos incluidos, estos generalmente se
encuentran en el orden de 109 para 8 estudios ya sea para las cepas
de Lactobacillus y Bifidobacterium, así como en las multicepas,
en los cuáles 7 de ellos (87,5 %) los pacientes mostraron mejoría significativa
en la sintomatología del SII. En el caso de la aplicación en el orden de 1010 UFC en 2 estudios desarrollados en este periodo se logró en al
menos un síntoma del SII su mejoría.(16,21)
DISCUSIÓN
En un análisis global de todos los estudios incluidos se observó que la combinación
de cepas de Lactobacillus y Bifidobacterium(8,16,19,20) o
su combinación adicional con S. thermophilus(13,25) demostraron
la mejoría significativa del dolor y la distensión abdominal.
También se observó mejoría significativa de la diarrea y el estreñimiento, con
la aplicación de B. coagulans MTCC,(9) B. coagulans
LBSC,(23) B. bifidum MIMBb75(18) en comparación
a un placebo. El uso de prebióticos como la inulina y los fructooligosacáridos
(FOS) en las fórmulas con microorganismos fue beneficioso para mejorar los síntomas
del dolor abdominal, la distensión abdominal y el estreñimiento en los estudios
de Mezzasalma V y otros(8) y Lee SH y otros.(16)
En cuanto al tiempo de tratamiento, 2 trabajos(14,19) consideraron
como mínimo 4 semanas y el tiempo máximo empleado en los ensayos clínicos fue
de 16 semanas en la investigación de Cremon C y otros(12)
con Lactobacillus paracasei CNCM I - 1572; e Ishaque S y otros(13)
con la combinación de cepas de Bifidobacterium spp, Lactobacillus spp, B.
subtilis PXN 21, Lactococcus lactis PXN 63 y S. thermophilus PXN 66. La
duración del tratamiento más frecuentemente empleada es la correspondiente a
8 semanas en los estudios de Hod K y otros,(11) Shin S
y otros,(14) Lee S y otros,(16) Madempudi
R y otros,(17) Andrensen V y otros,(18) Kim
J y otros,(20) Skrzydlo B y otros,(22,25)
de los cuales se observó un efecto en la reducción de los síntomas con la aplicación
de probióticos del género Lactobacillus, Bifidobacterium o como
multicepas con otros microorganismos como S. thermophilus, así como también
de B. coagulanscomo única cepa. Esto difiere a la revisión sistemática
de Chen M y otros,(26) quienes concluyeron que los probióticos
tuvieron un efecto a corto plazo (4 semanas) en la reducción de los síntomas
globales y del dolor abdominal en el SII.
Los probióticos pueden ayudar a reducir los síntomas del SII al estabilizar
la microbiota intestinal y modular la respuesta inmune al establecer un equilibrio
entre las citocinas proinflamatorias y antiinflamatorias.(27) La
interleucina 10 (IL-10) juega un papel crucial en la regulación de la inflamación
al inhibir la proliferación de células Th1 y células natural killer (NK), la
producción de citocinas proinflamatorias como IL-1, IL-6, IL-12 y el factor
de necrosis tumoral (TNF), y la producción de óxidos de nitrógeno reactivos.
Se demostró que Lactobacillus y Bifidobacterium pueden influir
en la producción de IL-10 en líneas celulares de macrófagos de ratón.(28)
Sin embargo, también estos mecanismos benéficos en la disminución de citocinas
proinflamatroias se observaron en líneas celulares de cáncer de colon con L.
reuteri DSM 25175 y L. acidophilus DSM 24936 y en modelo experimental
de colitis inducida.(29,30)
Los pacientes con diarrea muestran signos de alteración en la barrera de la
mucosa intestinal, lo que se refleja en un aumento de la permeabilidad intestinal
y un incremento en linfocitos T, mastocitos y células enterocromafines, debido
a una posible inflamación en el SII.(27) Una cepa probiótica que
pueda activar la producción de IL-10 podría mejorar la calidad de vida de los
pacientes con SII, reducir la duración de los síntomas y potencialmente tratar
la enfermedad.(28) Por lo tanto, el uso de probióticos que interactúen
con el epitelio del huésped para mitigar la inflamación y proteger la función
de barrera se presenta como una opción terapéutica.
Los pacientes suplementados con B. longum BB536 y L. rhamnosus HN001,(19)
así como con L. acidophilus DDS-1 y B. lactis UABla-12,(21)
experimentaron un aumento de bacterias ácido lácticas y bifidobacterias, una
producción abundante de ácidos grasos de cadena corta y una disminución del
p-cresol. Esto tuvo mejoras significativas en el SII, con respecto al dolor
abdominal y la distensión abdominal en comparación con el grupo control.(21)
Sin embargo, es importante señalar que estas mezclas de microorganismos
pueden estar acompañadas de fibra, como FOS e inulina, para su crecimiento,
en productos denominados simbióticos. En la presente revisión se encontraron
3 estudios(8,16,24) que utilizaron simbióticos en los que se redujó
la distensión abdominal del SII, no obstante el tratamiento con simbióticos
no demostró efecto sobre el dolor abdominal.(16,22,24) Aquí es importante
considerar la dosis del prebiótico, ya que si esta es pequeña puede ser inútil
en el tratamiento, así como si está en dosis mayores favorece la producción
de gases y empeoraría la sintomatología.(27)
La combinación de 4 x 109 UFC de B. longum BB536 y 1x 109 UFC de L. rhamnosus HN001 más vitamina B6 mostró resultados
beneficiosos sobre la sintomatología del SII en el grupo intervenido.(19)
aunque, se encontró un estudio en el que el tratamiento se llevó a cabo con
2,4 x 1010 células de L. paracasei CNCM I - 1572 / día que
redujo la sintomatología del dolor abdominal pero no de manera significativa
en comparación con el placebo,(12) en tanto que en los estudios de
Shin S y otros,(14) Lee S y otros(16)
y Martoni C y otros(21) en el orden de 1010 células
viables, se observan efectos beneficiosos significativos. Sin embargo, todos
estos estudios mencionados son pilotos y la muestra es pequeña, por lo que los
resultados deben ser considerados con mesura.
Los resultados favorables del tratamiento del SII con probióticos encontrados
en la presente revisión corroboran con lo indicado por Jian-Rong S
y otros,(31) quienes consideraron una revisión sistemática en estudios
antes del 2016, así como los criterios Roma I y II. Asimismo, Ceccherini
C y otros,(32) realizaron una revisión sistemática y métodos
de análisis de decisiones multicriterio en la que determinaron que las formulaciones
basadas en L. rhamnosus y L. acidophilus tienen la mayor eficacia
en la calidad de vida, la hinchazón y el dolor abdominal. Sin embargo, en dicha
revisión sistemática los estudios evaluados incluían, además de los adultos,
a los niños.
La evidencia incluida en esta revisión tiene limitaciones debido a la variabilidad
en los estudios, en cuanto a la dosis del suplemento, el tamaño de la muestra
y la duración del tratamiento. La dieta que puede afectar la fisiología gastrointestinal,
debe considerarse como un posible sesgo en los ensayos del SII. Pocos estudios
miden la ingesta dietética y los placebos pueden contener ingredientes que desencadenan
el SII. La tolerancia al placebo y al probiótico, así como las tasas de adherencia
en los estudios dietéticos, son factores relevantes a tener en cuenta.
Así mismo en esta revisión también es probable el sesgo de publicación, en cuanto
a que alguna fuente no sea considerada, debido al uso específico de bases de
datos de las que disponía la universidad.
Aunque es crucial homogeneizar aspectos como la dosis, la composición del placebo,
la dieta, la relación probiótico/prebiótico y la uniformidad en el conjunto
de cepas utilizadas en el diseño metodológico para reducir posibles sesgos en
los resultados, estos aspectos aún requieren mayor atención por parte de los
investigadores. Esta estandarización facilitaría recomendaciones más precisas
por parte de los profesionales de la salud. Sin embargo, la mayoría de los estudios
han demostrado que los probióticos tienen un efecto beneficioso en la reducción
de los síntomas del síndrome del intestino irritable (SII).
Agradecimientos
Los autores agradecen el apoyo de la Escuela de Nutrición de la Universidad
César Vallejo de Trujillo.
REFERENCIAS BIBLIOGRÁFICAS
1. González M, De Ascencao M. Síndrome del Intestino Irritable. Aspectos Psicológicos
[Internet]. Revista de la Facultad de Medicina. 2021 [acceso: 08/12/2021]; 28(2):139-45.
Disponible en: http://ve.scielo.org/scielo.php?pid=S0798-04692005000200007&script=sci_arttext&tlng=en
2. Mariños H, Chafloque A. Asociación entre el Síndrome de Intestino Irritable
y la ansiedad y depresión en pacientes atendidos en el Hospital Regional Docente
de Trujillo [Internet]. Rev Med Trujillo. 2019; 14(4):181-88. DOI:
10.17268/rmt.2019.v14i04.05
3. Barberio B, Houghton LA, Yiannakou Y, Savarino EV, Black CJ, Ford AC. Symptom
Stability in Rome IV vs Rome III Irritable Bowel Syndrome [Internet]. Am J Gastroenterol.
2021; 116(2):362-71. DOI:
10.14309/ajg.0000000000000946
4. Satish L, Pugalenthi L, Ahmad M, Reddy S, Barkhane Z, Elmadi J. Probiotics
in Irritable Bowel Syndrome: A Review of Their Therapeutic Role [Internet].
Cureus. 2022; 14(4):1-10. DOI:
10.7759/cureus.24240
5. Marlicz W, Skonieczna-Zydecka K, Krynicka P, Loniewski I, Rydzewska G. Probiotics
in irritable bowel syndrome - is the quest for the right strain over? Rapid
review of existing guidelines and recommendations [Internet]. Prz Gastroenterol.
2021; 16(4):369-82. DOI:
10.5114/pg.2021.111766
6. Camilleri M. Irritable Bowel Syndrome: Straightening the road from the Rome
criteria [Internet]. Neurogastroenterol Motil. 2020; 32(11):1-15. DOI: 10.1111/nmo.13957
7. Page MJ, Mckenzie JE, Bossuyt PM, Boutron I, Hoffmann TC, Mulrow CD, et al.
The PRISMA 2020 statement: an updated guideline for reporting systematic reviews
[Internet]. BMJ. 2021; 372(71):1-8. DOI:
10.1136/bmj.n71
8. Mezzasalma V, Manfrini E, Ferri E, Sandionigi A, La Ferla B, Schiano I, et
al. A Randomized, Double-Blind, Placebo-Controlled Trial: The Efficacy of Multispecies
Probiotic Supplementation in Alleviating Symptoms of Irritable Bowel Syndrome
Associated with Constipation [Internet]. Biomed Res Int. 2016; 2016(1):4740907.
DOI: 10.1155/2016/4740907
9. Majeed M, Nagabhushanam K, Natarajan S, Sivakumar A, Ali F, Pande A, et al.
Bacillus coagulans MTCC 5856 supplementation in the management of diarrhea predominant
Irritable Bowel Syndrome: A double blind randomized placebo controlled pilot
clinical study [Internet]. Nutr J. 2016; 15:21. DOI:
10.1186/s12937-016-0140-6
10. Šmid A, Strniša L, Bajc K, Vujic-Podlipec D, Bogovic Matijašic B, Rogelj
I. Randomized clinical trial: The effect of fermented milk with the probiotic
cultures Lactobacillus acidophilus La-5® and Bifidobacterium BB-12® and Beneo
dietary fibres on health-related quality of life and the symptoms of irritable
bowel syndrome in adult [Internet]. J Funct Foods. 2016; 24(Suppl. 3 Pt. 2):549-57.
DOI: 10.1016/j.jff.2016.04.031
11. Hod K, Sperber AD, Ron Y, Boaz M, Dickman R, Berliner S, et al. A double-blind,
placebo-controlled study to assess the effect of a probiotic mixture on symptoms
and inflammatory markers in women with diarrhea-predominant IBS [Internet].
Neurogastroenterol Motil. 2017; 29(7):1-10. DOI:
10.1111/nmo.13037
12. Cremon C, Guglielmetti S, Gargari G, Taverniti V, Castellazzi AM, Valsecchi
C, et al. Effect of Lactobacillus paracasei CNCM I-1572 on symptoms, gut microbiota,
short chain fatty acids, and immune activation in patients with irritable bowel
syndrome: A pilot randomized clinical trial [Internet]. United Eur Gastroenterol
J. 2018; 6(4):604-13. DOI:
10.1177/2050640617736478
13. Ishaque SM, Khosruzzaman SM, Ahmed DS, Sah MP. A randomized placebo-controlled
clinical trial of a multi-strain probiotic formulation (Bio-Kult®) in the management
of diarrhea-predominant irritable bowel syndrome [Internet]. BMC Gastroenterol.
2018; 18(1):71. DOI:
10.1186/s12876-018-0788-9
14. Shin SP, Choi YM, Kim WH, Hong SP, Park JM, Kim J, et al. A double blind,
placebo-controlled, randomized clinical trial that breast milk derived-Lactobacillus
gasseri BNR17 mitigated diarrhea-dominant irritable bowel syndrome [Internet].
J Clin Biochem Nutr. 2018; 62(2):179-86. DOI:
10.3164/jcbn.17-73
15. Sun YY, Li M, Li YY, Li LX, Zhai WZ, Wang P, et al. The effect of Clostridium
butyricum on symptoms and fecal microbiota in diarrhea-dominant irritable bowel
syndrome: A randomized, double-blind, placebo-controlled trial [Internet]. Sci
Rep. 2018; 8(1):2964. DOI:
10.1038/s41598-018-21241-z
16. Lee SH, Cho DY, Lee SH, Han KS, Yang SW, Kim JH, et al. A Randomized Clinical
Trial of Synbiotics in Irritable Bowel Syndrome: Dose-Dependent Effects on Gastrointestinal
Symptoms and Fatigue [Internet]. Korean J Fam Med. 2019; 40(1):2-8. DOI:
10.4082/kjfm.17.0064
17. Madempudi RS, Ahire JJ, Neelamraju, J, Tripathi A, Nanal S. Randomized clinical
trial: the effect of probiotic Bacillus coagulans Unique IS2 vs. placebo on
the symptoms management of irritable bowel syndrome in adults [Internet]. Sci
Rep. 2019; 9(1):12210. DOI:
10.1038/s41598-019-48554-x
18. Andresen V, Gschossmann J, Layer P. Heat-inactivated Bifidobacterium bifidum
MIMBb75 (SYN-HI-001) in the treatment of irritable bowel syndrome: a multicentre,
randomised, double-blind, placebo-controlled clinical trial [Internet]. The
Lancet Gastroenterology and Hepatology. 2020 [acceso: 05/03/2022]; 5(7):658-
66. Disponible en: https://bit.ly/47rfzYz
19. Bonfrate L, Di Palo DM, Celano G, Albert A, Vitellio P, De Angelis M, et
al. Effects of Bifidobacterium longum BB536 and Lactobacillus rhamnosus HN001
in IBS patients [Internet]. Eur J Clin Invest. 2020; 50(3):e13201. DOI: 10.1111/eci.13201
20. Kim J, Cho K, Kim JS, Jung HC, Kim B, Park MS, et al. Probiotic treatment
induced change of inflammation related metabolites in IBS-D patients/double-blind,
randomized, placebo-controlled trial [Internet]. Food Sci Biotechnol. 2020;
29(6):837-44. DOI:
10.1007/s10068-019-00717-2
21. Martoni CJ, Srivastava S, Leyer GJ. Lactobacillus acidophilus DDS-1 and
Bifidobacterium lactis UABla-12 Improve Abdominal Pain Severity and Symptomology
in Irritable Bowel Syndrome: Randomized Controlled Trial [Internet]. Nutrients.
2020; 12(2):363. DOI:
10.3390/nu12020363
22. Skrzydlo B, Prozorow B, Cichoz H, Majsiak E, Bierla JB, Kosikowski W, et
al. The Effectiveness of Synbiotic Preparation Containing Lactobacillus and
Bifidobacterium Probiotic Strains and Short Chain Fructooligosaccharides in
Patients with Diarrhea Predominant Irritable Bowel Syndrome-A Randomized Double-Blind,
Placebo-Controlled Study [Internet]. Nutrients. 2020; 12(7):1999. DOI:
10.3390/nu12071999
23. Gupta AK, Maity C. Efficacy and safety of Bacillus coagulans LBSC in irritable
bowel syndrome. A prospective, interventional, randomized, double-blind, placebo-controlled
clinical study [CONSORT Compliant] [Internet]. Medicine. 2021; 100(3):e23641.
DOI:
10.1097/MD.0000000000023641
24. Liu Y, Yu X, Yu L, Tian F, Zhao J, Zhang H, et al. Lactobacillus plantarum
CCFM8610 Alleviates Irritable Bowel Syndrome and Prevents Gut Microbiota Dysbiosis:
A Randomized, Double-Blind, Placebo-Controlled, Pilot Clinical Trial [Internet].
Engineering. 2021; 7(3):376- 85. DOI:
10.1016/j.eng.2020.06.026
25. Skrzydlo B, Prozorow B, Cichoz H, Majsiak E, Bierla JB, Kanarek E, et al.
The Effectiveness and Safety of Multi-Strain Probiotic Preparation in Patients
with Diarrhea-Predominant Irritable Bowel Syndrome: A Randomized Controlled
Study [Internet]. Nutrients. 2021; 13(3):756. DOI:
10.3390/nu13030756
26. Chen M, Yuan L, Chao-Rong X, Xiao-Ying W, Si-Jia F, Xin-Yu X, et al. Probiotics
for the management of irritable bowel syndrome: a systematic review and three-level
meta-analysis [Internet]. Int J Surg. 2023; 109(11):3631-47. DOI:
10.1097/JS9.0000000000000658
27. Benjak Horvat I, Gobin I, Kresovic A, Hauser G. How can probiotic improve
irritable bowel syndrome symptoms? [Internet]. World J Gastrointest Surg. 2021;
13(9):923-40. DOI:
10.4240/wjgs.v13.i9.923
28. Liang H, Luo Z, Miao Z, Shen X, Li M, Zhang Z, et al. Lactobacilli and bifidobacteria
derived from infant intestines may activate macrophages and lead to different
IL-10 secretion [Internet]. Biosci Biotechnol Biochem. 2020; 84(12):2558-68.
DOI:
10.1080/09168451.2020.1811948
29. Cocetta V, Giacomini I, Tinazzi M, Berretta M, Quagliariello V, Maurea N,
et al. Maintenance of intestinal epithelial barrier integrity by a combination
of probiotics, herbal extract, and vitamins [Internet]. Minerva Pediatrics.
2023; 75(1):1-9. DOI:
10.23736/S2724-5276.23.07128-8
30. Konturek P, Konturek K, Brzozowski T, Wojcik D, Magierowski M, Targosz A,
et al. Participation of the intestinal microbiota in the mechanism of beneficial
effect of treatment with synbiotic syngut on experimental colitis under stress
conditions [Internet]. Journal of Physiology and Pharmacology. 2020; 71(3):329-42.
DOI: 10.26402/jpp.2020.3.03
31. Jian-Rong S, Chen-Fan K, Xiang-Ke Q, Chao D, Yan-Ni L, Li-Qun J. Efficacy
and safety of probiotics in irritable bowel syndrome. A systematic review and
meta-analysis [Internet]. Saudi Journal of Gastroenterology. 2020; 26(2):66-77.
DOI: 10.4103/sjg.SJG_384_19
32. Ceccherini C, Daniotti S, Bearzi C, Re I. Evaluating the Efficacy of Probiotics
in IBS Treatment Using a Systematic Review of Clinical Trials and Multi-Criteria
Decision Analysis [Internet]. Nutrients. 2022; 14(13):2689. DOI:
10.3390/nu14132689
Conflictos
de interés
Se declara que no existen conflictos de interés.
Información
financiera
Los autores declaran que no hubo subvenciones involucradas en este trabajo
Contribuciones
de los autores
Conceptualización: Ana Flavia Naomy Paredes Cancino, Merlin Goretti Alonzo
De La Cruz, Jorge Luis Díaz-Ortega.
Curación
de datos: Ana Flavia Naomy Paredes Cancino, Merlin Goretti Alonzo De La
Cruz, Jorge Luis Díaz-Ortega.
Análisis
Formal: Ana Flavia Naomy Paredes Cancino, Merlin Goretti Alonzo De La Cruz,
Jorge Luis Díaz-Ortega.
Metodología:
Ana Flavia Naomy Paredes Cancino, Merlin Goretti Alonzo De La Cruz, Jorge
Luis Díaz-Ortega.
Administración
del Proyecto: Ana Flavia Naomy Paredes Cancino, Merlin Goretti Alonzo De
La Cruz, Jorge Luis Díaz-Ortega.
Software:
Ana Flavia Naomy Paredes Cancino, Merlin Goretti Alonzo De La Cruz, Jorge
Luis Díaz-Ortega.
Supervisión:
Jorge Luis Díaz Ortega.
Validación:
Ana Flavia Naomy Paredes Cancino, Merlin Goretti Alonzo De La Cruz, Jorge
Luis Díaz-Ortega.
Visualización:
Ana Flavia Naomy Paredes Cancino, Merlin Goretti Alonzo De La Cruz, Jorge
Luis Díaz-Ortega.
Redacción
- Elaboración del borrador original: Ana Flavia Naomy Paredes Cancino, Merlin
Goretti Alonzo De La Cruz, Jorge Luis Díaz-Ortega.
Redacción
- Revisión y edición: Ana Flavia Naomy Paredes Cancino, Merlin Goretti Alonzo
De La Cruz, Jorge Luis Díaz-Ortega.
Disponibilidad
de datos
No hay datos asociados con este artículo.
Archivos complementarios:
Lista de chequeo PRISMA: https://revmedmilitar.sld.cu/index.php/mil/libraryFiles/downloadPublic/33
Ecuación booleana para la búsqueda: https://revmedmilitar.sld.cu/index.php/mil/libraryFiles/downloadPublic/34


